题目内容
19.A、B、C、D、E、X为中学常见物质,它们的转化关系如图所示(反应条件未注明).请根据题中信息回答问题.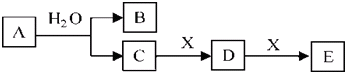
(1)若A为短周期元素的单质,E为白色难溶物且既能溶于盐酸又能溶于C溶液,则
①D与X发生反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓;
②常温下pH=10的C溶液与D溶液中,水的电离程度NaAlO2大(选填C或D的化学式).
(2)若A为氧化物,常温下X在浓的C溶液中发生钝化,则
①X在元素周期表中的位置为第四周期第ⅤⅢ族;
②含a mol D的溶液溶解了一定量的X后得到溶液F,若F溶液中的两种金属阳离子的物质的量相等(不考虑水解因素),被还原的D是0.4amol(用含a 的式子表示);
③请设计方案鉴别F溶液中的金属阳离子取少量F溶液于试管中,滴加几滴KSCN溶液,若溶液呈血红色,则含有Fe3+;另取少F溶液于试管中,滴加几滴KMnO4溶液,若溶液紫色褪去则含有Fe2+.
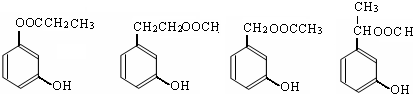
(3)若A为有机物,B和D均能发生银镜反应,且B和C相对分子质量相等,写出A的结构简式HCOOCH2CH3,写出C→D的化学方程式2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
分析 (1)若A为单质,E为白色难溶物且既能溶于盐酸又能溶于C溶液,根据题中各物的转化关系,C能连续与X反应,可推知,A为钠,B为氢气,C为氢氧化钠,X为氯化铝,D为偏铝酸钠,E为氢氧化铝;
(2)若A为氧化物,常温下X在浓的C溶液中发生钝化,结合题中各物质转化关系,可知A为NO2,C为HNO3,X为Fe,所以B为NO,D为Fe(NO3)3,E为Fe(NO3)2;
(3)若A为有机物,由转化关系可知A为酯类物质,B为酸,C为醇,B和D均能发生银镜反应,可知B为HCOOH,且B和C相对分子质量相等,则C为CH3CH2OH,D为CH3CHO;E为CH3COOH,以此解答该题.
解答 解:(1)若A为单质,E为白色难溶物且既能溶于盐酸又能溶于C溶液,根据题中各物的转化关系,C能连续与X反应,可推知,A为钠,B为氢气,C为氢氧化钠,X为氯化铝,D为偏铝酸钠,E为氢氧化铝,
①D与X发生反应的离子方程式为3AlO2-+Al3++6H2O=4Al(OH)3↓,
故答案为:3AlO2-+Al3++6H2O=4Al(OH)3↓;
②由于氢氧化钠溶液是强碱,对水的电离有抑制作用,而偏铝酸根离子发生水解,对水的电离起促进作用,所以常温下pH=10的氢氧化钠溶液与偏铝酸钠溶液中,水的电离程度NaAlO2大,
故答案为:NaAlO2;
(2)若A为氧化物,常温下X在浓的C溶液中发生钝化,结合题中各物质转化关系,可知A为NO2,C为HNO3,X为Fe,所以B为NO,D为Fe(NO3)3,E为Fe(NO3)2,
①铁在元素周期表中的位置为第四周期第ⅤⅢ族,
故答案为:第四周期第ⅤⅢ族;
②含a mol Fe(NO3)3的溶液溶解了一定量的Fe后得到溶液F,设被还原的D是xmol,当xmolFe3+被还原时,会有1.5xmol的生成Fe2+,由于F溶液中的两种金属阳离子即Fe2+和Fe3+的物质的量相等,所以有1.5x=a-x,所以x=0.4a,
故答案为:0.4a;
③鉴别F溶液中的Fe2+和Fe3+离子,可以用KSCN溶液和KMnO4溶液,具体操作为:取少量F溶液于试管中,滴加几滴KSCN溶液,若溶液呈血红色,则含有Fe3+;另取少F溶液于试管中,滴加几滴KMnO4溶液,若溶液紫色褪去则含有Fe2+,
故答案为:取少量F溶液于试管中,滴加几滴KSCN溶液,若溶液呈血红色,则含有Fe3+;另取少F溶液于试管中,滴加几滴KMnO4溶液,若溶液紫色褪去则含有Fe2+;
(3)若A为有机物,由转化关系可知A为酯类物质,B为酸,C为醇,B和D均能发生银镜反应,可知B为HCOOH,且B和C相对分子质量相等,则C为CH3CH2OH,D为CH3CHO;E为CH3COOH,A应为HCOOCH2CH3,C→D的化学方程式为2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O,
故答案为:HCOOCH2CH3;2CH3CH2OH+O2 $→_{△}^{Cu}$2CH3CHO+2H2O.
点评 本题考查无机物以及有机物的推断,为高考常见题型和高频考点,侧重考查学生的分析能力,注意把握物质的转化关系,物质性质的应用,题目着重铁及其化合物,氮及其化合物,铝及其化合物性质的应用和判断,综合性较强,有一定的难度,答题时注意元素化合知识的灵活运用.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 存在两种化学键 | B. | 含共价键的离子化合物 | ||
| C. | 存在两种离子 | D. | 含共价键的共价化合物 |
| A | B | C | D | |
| 正极 | Zn | Ag | Cu | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | FeCl2 | CuSO4 |
| A. | A | B. | B | C. | C | D. | D |
| A. | CO(g)燃烧热△H=-283.0 kJ•mol-1,则反应2CO2(g)=2CO(g)+O2(g)的△H=2×283.0kJ•mol-1 | |
| B. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| C. | C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1,说明金刚石比石墨稳定 | |
| D. | 相同状况下,H2在Cl2中燃烧生成1molHCl和H2与Cl2光照爆炸生成1molHCl的反应热不相同 |
| A. | 浓硫酸溶于水 | B. | 碳与水蒸气的反应 | ||
| C. | 氯酸钾受热分解 | D. | 酸碱中和 |
 LiOH和钴氧化物可用于制备锂离子电池正极材料.利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法不正确的是( )
LiOH和钴氧化物可用于制备锂离子电池正极材料.利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.下列说法不正确的是( )| A. | B极区电解液为LiOH溶液 | |
| B. | 每产生标准状况下2.24L氢气,就有0.1 mol阳离子通过交换膜进入阴极区 | |
| C. | 电解过程中Li+向B电极迁移 | |
| D. | 阳极电极反应式为2Cl--2e-=Cl2↑ |
| A. | 在食品袋中放入CaCl2•6H2O,可防止食物受潮 | |
| B. | “从沙滩到用户”,计算机芯片的材料是指单质硅 | |
| C. | 二氧化硫有毒,严禁将其添加到任何食品和饮料中 | |
| D. | 用Al(OH)3可以做塑料的阻燃剂,因为它受热熔化放出大量的热 |
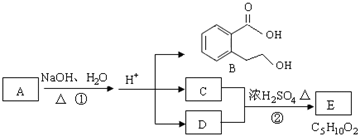
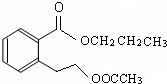 或
或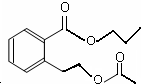 .
. .
. A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,C、D同一主族,D元素原子M层有一对成对的p电子,元素E位于周期表ⅠB族.请回答下列相关问题(涉及元素的请用对应的元素符号冋答)
A、B、C、D、E是前四周期的核电荷数依次增大元素,A原子核外s轨道电子数是p轨道电子数的2倍,C、D同一主族,D元素原子M层有一对成对的p电子,元素E位于周期表ⅠB族.请回答下列相关问题(涉及元素的请用对应的元素符号冋答)