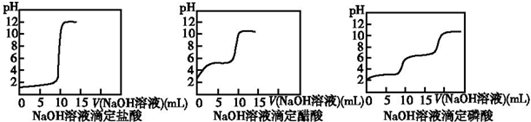
题目内容
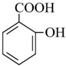
2.水杨酸某酯E的合成路线如图所示: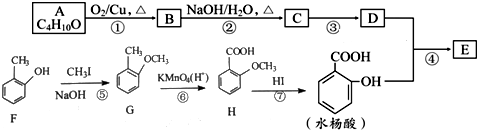
已知:①2RCH2CHO$→_{△}^{NaOH/H_{2}O}$R-
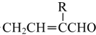
②A分子中只含有1个甲基;③D的相对分子质量为130;
(1)C中含氧官能团的名称为醛基;反应④的反应方程式为CH3CH2CH2CH2CH(CH2CH3)CH2OH+
 →
→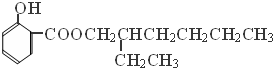 +H2O;
+H2O;(2)在合成路线中,设计⑤和⑦的目的防止苯环上的酚羟其被氧化;
(3)X是B的最简单同系物,请写出X与足量银氨溶液反应的离子方程式HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32++2NH4++4Ag↓+6NH3+2H2O;
(4)下列有关说法正确的是a;
a.B中有4种不同的氢
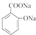
b.水杨酸与足量NaHCO3反应生成
c.D不与金属钠反应
d.1mol E与氢气加成,最多消耗4mol H2
(5)H有多种同分异构体,其中能同时满足下列条件的共有13种(不考虑立体异构)
①能发生银镜反应;②能发生水解反应;③能与FeCl3溶液发生显色反应,其中有5种氢,且氢的个数比为1:1:2:2:2的为
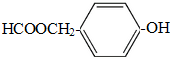 (写结构简式).
(写结构简式).
分析 A的分子式为C4H10O,分子中只含有1个甲基,可以发生催化氧化,则A的结构简式为CH3CH2CH2CH2OH,B的结构简式为CH3CH2CH2CHO,由题目信息可知C的结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,D的相对分子质量为130,比C的相对分子质量大4,E为水杨酸酯,则D结构简式为CH3CH2CH2CH2CH(CH2CH3)CH2OH,C和氢气发生加成反应生成D,D和邻羟基苯甲酸发生酯化反应生成E,E结构简式为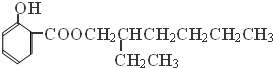 ,F发生取代反应生成G,G发生氧化反应生成H,H发生取代反应生成水杨酸,设计⑤和⑦的目的防止苯环上的酚羟其被氧化.
,F发生取代反应生成G,G发生氧化反应生成H,H发生取代反应生成水杨酸,设计⑤和⑦的目的防止苯环上的酚羟其被氧化.
解答 解:A的分子式为C4H10O,分子中只含有1个甲基,可以发生催化氧化,则A的结构简式为CH3CH2CH2CH2OH,B的结构简式为CH3CH2CH2CHO,由题目信息可知C的结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,D的相对分子质量为130,比C的相对分子质量大4,E为水杨酸酯,则D结构简式为CH3CH2CH2CH2CH(CH2CH3)CH2OH,C和氢气发生加成反应生成D,D和邻羟基苯甲酸发生酯化反应生成E,E结构简式为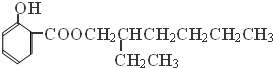 ,F发生取代反应生成G,G发生氧化反应生成H,H发生取代反应生成水杨酸,设计⑤和⑦的目的防止苯环上的酚羟其被氧化.
,F发生取代反应生成G,G发生氧化反应生成H,H发生取代反应生成水杨酸,设计⑤和⑦的目的防止苯环上的酚羟其被氧化.
(1)C的结构简式为CH3CH2CH2CH=C(CH2CH3)CHO,C中含氧官能团的名称为醛基,反应④的反应方程式为:CH3CH2CH2CH2CH(CH2CH3)CH2OH+ →
→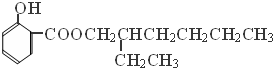 +H2O,
+H2O,
故答案为:醛基;CH3CH2CH2CH2CH(CH2CH3)CH2OH+ →
→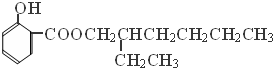 +H2O;
+H2O;
(2)在合成路线中,设计⑤和⑦的目的:防止苯环上的酚羟其被氧化,
故答案为:防止苯环上的酚羟其被氧化;
(3)X是B的最简单同系物,则X为HCHO,与足量银氨溶液反应的离子方程式:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32++2NH4++4Ag↓+6NH3+2H2O,
故答案为:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32++2NH4++4Ag↓+6NH3+2H2O;
(4)a.B为CH3CH2CH2CHO,有4种不同的氢,故a正确;
b.羧基能与碳酸氢钠反应,而酚羟基不能够与碳酸氢钠反应,故b错误;
c.D中含有醇羟基,能与金属钠反应,故c错误;
d.E中苯环能与氢气发生加成反应,1mol E与氢气加成,最多消耗3mol H2,故d错误.
故选:a;
(5)H有多种同分异构体,其中能同时满足下列条件:①能发生银镜反应,说明含有醛基,②能发生水解反应,说明含有酯基,为甲酸形成的酯基,③能与FeCl3溶液发生显色反应,说明含有酚羟基,含有2个侧链,除酚羟基外,另外的取代基为-CH2OOCH,有邻、间、对3种,含有3个取代基为-OH、-CH3、-OOCH,当-OH、-CH3有邻、间、对3种位置,对应的-OOCH分别有4种、4种、2种位置,故符合条件的同分异构体共有13种,其中有5种氢,且氢的个数比为1:1:2:2:2的为 ,
,
故答案为:13; .
.
点评 本题考查有机物的推断与合成,正确推断出A物质是解本题关键,结合题给信息进行分析解答,熟练掌握官能团的性质与转化,注意苯环上二元取代与三元取代同分异构体的判断.

| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能 (kJ•mol-1) | 386 | 167 | 498 | 946 | 460 |
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液.肼-空气燃料电池放电时,正极的电极反应式是O2+2H2O+4e-=4OH-.
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有90个N-N键.
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | H2O | B. | Na2CO3溶液 | C. | 石蕊试液 | D. | NaHSO4溶液 |
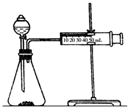 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短)可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用(或催化剂)的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
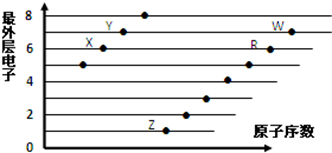
| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的酸性:X>Y | |
| D. | X、Z形成的化合物中阴阳离子个数比为1:2 |
| A. | R为ⅤA族元素 | |
| B. | R的氢化物的水溶液属于强酸 | |
| C. | 氧化剂与还原剂的物质的量之比为5:1 | |
| D. | R2在常温常压下一定是气体 |
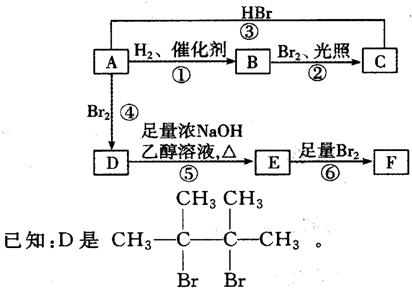
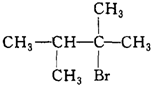 .
. ;;写出由E-F的化学方程式
;;写出由E-F的化学方程式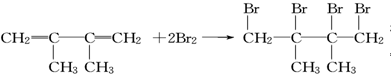 .
. .
. .
.