题目内容
5.某实验探究小组用如图1装置来研究影响浓氨水与生石灰反应制氨气的反应速率(实验在通风柜中进行).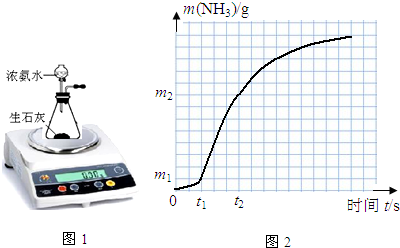
(1)有人认为:既然是以测定氨气的量来求反应速率,装置需再作改进,在上图中画出需改进的装置并注明所盛试剂的名称(不必考虑空气成分的作用).
根据改进后的装置进行实验,通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量可求反应速率v(NH3).为实现如表的实验目的,请完善以下实验方案(c(NH3•H2O)=15mol•L-1、CaO的质量相同、若溶液的体积相同实验过程中温度变化基本相同)和实验结论(填写待测物理量及用字母表示的数据)
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
①若忽略溶液体积的变化,以氨水浓度变化量表示t1~t2时间内的反应速率为v(NH3•H2O)=$\frac{25({m}_{2}-{m}_{1})}{17({t}_{2}-{t}_{1})}$mol/(L•s)(用代数式表示);
②若将30mL浓氨水平均分三次加入粉末状CaO中,与实验1相比,0~t1时反应速率快(填“快”、“慢”、“相等”或“无法确定”),其原因是a.起始氨水浓度大;b.氨水的体积少,(CaO与H2O)反应放热使得溶液温度相对较高,反应消耗H2O使得氨水浓度相对较大.
分析 (1)实验目的是通过装置反应前后质量变化来测氨气的产生速率,产生的氨气中有水蒸气,不能离开装置,否则产生误差;实验通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量,可知氨气的反应速率;通过控制变量法设计实验;
(2)①根据图象计算t1~t2之间生成NH3的物质的量,即消耗NH3•H2O的量,由于忽略溶液体积变化,所以v(NH3•H2O)=$\frac{△c}{△t}$;
②浓度和温度对反应速率的影响.
解答 解:(1)实验目的是通过装置反应前后质量变化来测氨气的产生速率,产生的氨气中有水蒸气,不能离开装置,否则产生误差,所以用装碱石灰的干燥管吸收水蒸气;实验通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量,可知氨气的反应速率;实验1和实验2探究固体比表面积,让其他条件相同,氧化钙的状态不同,所以实验2为块状;实验1和实验3探究氨水浓度对v(NH3)的影响,让氧化钙的状态相同,氨水的浓度不同,控制溶液的总体积相同,实验3说明总体积为40mL,所以实验1、2水的体积都为10mL,
故答案为: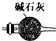 ;产生等质量的NH3所需的时间或相同时间内生成NH3的质量;
;产生等质量的NH3所需的时间或相同时间内生成NH3的质量;
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | 产生等质量的NH3所需的时间t/s | |
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 10 | t1 | ||
| 实验2 | 10 | 块状 | t2 | ||
| 实验3 | 粉末状 | t3 |
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | 相同时间内生成NH3的质量m/g | |
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 10 | m1 | ||
| 实验2 | 10 | 块状 | m2 | ||
| 实验3 | 粉末状 | m3 |
(2)①t1~t2之间生成的NH3为(m2-m1)g,物质的量为(m2-m1)/17 mol,即消耗了(m2-m1)/17 molNH3•H2O,由于忽略溶液体积变化,所以v(NH3•H2O)=$\frac{△c}{△t}$=$\frac{({m}_{2}-{m}_{1})}{17}$÷(40×10-3)L÷(t2-t1)s=$\frac{25({m}_{2}-{m}_{1})}{17({t}_{2}-{t}_{1})}$mol/(L•s);
故答案为:v(NH3•H2O)=$\frac{25({m}_{2}-{m}_{1})}{17({t}_{2}-{t}_{1})}$mol/(L•s);
②30mL浓氨水平均分三次加入粉末状CaO中,与实验1相比,0~t1时反应速率更快,原因起始氨有两点,a.水浓度更大,氨水的体积少,b.CaO与H2O反应放热使得溶液温度相对较高,反应消耗H2O使得氨水浓度相对较大,
故答案为:a.水浓度更大,氨水的体积少;b.CaO与H2O反应放热使得溶液温度相对较高,反应消耗H2O使得氨水浓度相对较大.
点评 本题探究影响化学反应速率的因素,用控制变量法设计实验,化学反应速率的计算和浓度、温度对反应速率的影响的应用考查,难度适中.

练习册系列答案
相关题目
13.H2S是一种有臭鸡蛋气味的气体,其分子结构和H2O相似,但S-H键键能比O-H键键能低.下列判断错误的是( )
| A. | H2S分子呈V形 | |
| B. | H2S沸点低于H2O沸点,因为S-H键键能低 | |
| C. | H2S分子中只含σ键 | |
| D. | H2S分子稳定性低于H2O分子,因为O-H键键能高 |
11.能一次区分CH3COOH、CH3CH2OH、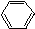 、
、 ,四种物质的是( )
,四种物质的是( )
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | H2O | B. | Na2CO3溶液 | C. | 石蕊试液 | D. | NaHSO4溶液 |
18.把Na0H溶液和CuSO4溶液加入某病人的尿液中,加热后观察到砖红色沉淀,说明尿液中含有( )
| A. | 脂肪 | B. | 白酒 | C. | 乙酸 | D. | 葡萄糖 |
10. 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
(1)该同学的实验目的是比较反应物本身的性质对反应速率的影响;
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短)可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用(或催化剂)的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短)可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用(或催化剂)的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
17.如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
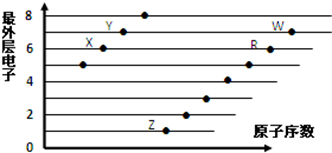

| A. | X和R在同一周期 | |
| B. | 原子半径:W>R>X | |
| C. | 气态氢化物的酸性:X>Y | |
| D. | X、Z形成的化合物中阴阳离子个数比为1:2 |
 .
. .
.