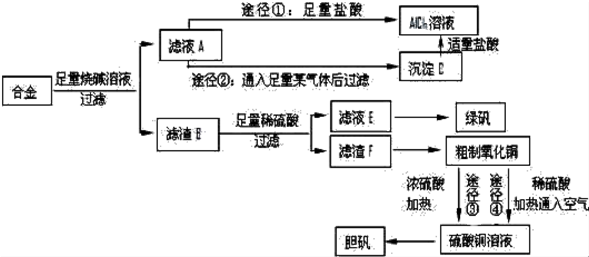
题目内容
19. 某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下:
某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下:Ⅰ用盐酸作催化剂
在一个大试管里加入苯酚2g,注入3mL甲醛溶液和3滴浓盐酸混合后,用带有玻璃管的橡皮塞塞好,放在沸水浴里加热约15min,待反应物接近沸腾时,液体变成白色浑浊状态,从水浴中取出试管,用玻璃棒搅拌反应物,稍冷,将试管中的混合物倒入蒸发皿中,倾去上层的水,下层就是缩聚成线型结构的热塑性酚酞树脂(米黄色中略带粉色)它能溶于丙酮.乙醇等溶剂中
Ⅱ用浓氨水作催化剂
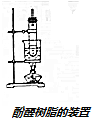
在另一个试管中加入2.5g苯酚,注入3~4mL,40%的甲醛溶液,混匀后再加1mL浓氨水,振荡混合,也用带有玻璃管的橡皮塞塞好,在水浴中加热(如图所示)约15min后,试管里逐渐出现白色的浑浊物,暂停加热,待发生的气泡稍少时,再继续加热,过一会儿,就变成黏稠的半流动性液体,将所得黏稠物倒入一瓷蒸发皿里,在50℃下烘1h后,再继续在70~80℃下烘8h,即能缩合成体型固体酚醛树脂(淡黄色),它不溶于任何溶剂
(1)写出酸性条件下生成酚醛树脂的反应方程式
①
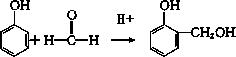
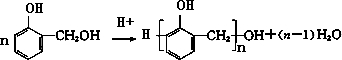
②
(2)实验装置采用沸水浴加热的原因沸水浴便于控制温度,受热均匀,加快反应速率,及时蒸出反应产物
(3)长玻璃导管起的作用为导气冷凝回流.
分析 (1)酸性条件下生成酚醛树脂的反应是苯酚和甲醛利用C-H键加成羰基生成邻羟基苯甲醇,酸溶液中邻羟基苯甲醇缩聚反应生成酚醛树脂;
(2)水浴便于控制温度,受热均匀,加快反应速率,及时蒸出反应产物;
(3)反应有大量热放出,苯酚、甲醛溶液易挥发,防止反应物因剧烈沸腾而蒸发掉.反应装置中的长玻璃管对挥发的反应物起冷凝回流作用.
解答 解:(1)酸性条件下生成酚醛树脂的反应是苯酚和甲醛利用C-H键加成羰基生成邻羟基苯甲醇,酸溶液中邻羟基苯甲醇缩聚反应生成酚醛树脂,反应的化学方程式为: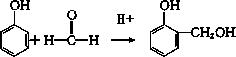 ,
, ,
,
故答案为: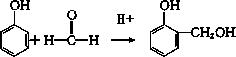 ,
, ;
;
(2)实验装置采用沸水浴加热的原因是:沸水浴便于控制温度,受热均匀,加快反应速率,及时蒸出反应产物,
故答案为:沸水浴便于控制温度,受热均匀,加快反应速率,及时蒸出反应产物;
(3)反应有大量热放出,苯酚、甲醛溶液易挥发,反应装置中的长玻璃管除导气外,还对对挥发的反应物起冷凝回流作用.
故答案为:导气冷凝回流.
点评 本题考查了酚醛树脂的制备方法和实验注意问题,掌握基础注意实验基本操作是解题关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列说法错误的是( )
| A. | ⅦA元素的氢化物中氟化氢的沸点最高 | |
| B. | 第三周期元素形成的简单离子的半径随原子序数的增大依次增大 | |
| C. | I2易溶于CCl4可以用相似相溶原理解释 | |
| D. | CH2=CH2分子中共有5个σ键和1个π键 |
10.通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.已知部分化学键的键能如下:
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态).1mol肼完全燃烧时放出的热量为577kJ.
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液.肼-空气燃料电池放电时,正极的电极反应式是O2+2H2O+4e-=4OH-.
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有90个N-N键.
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能 (kJ•mol-1) | 386 | 167 | 498 | 946 | 460 |
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液.肼-空气燃料电池放电时,正极的电极反应式是O2+2H2O+4e-=4OH-.
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有90个N-N键.
4.下列物质属于电解质的是( )
| A. | Cl2 | B. | NH3 | C. | FeSO4 | D. | 蔗糖 |
11.能一次区分CH3COOH、CH3CH2OH、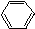 、
、 ,四种物质的是( )
,四种物质的是( )
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | H2O | B. | Na2CO3溶液 | C. | 石蕊试液 | D. | NaHSO4溶液 |
10. 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
(1)该同学的实验目的是比较反应物本身的性质对反应速率的影响;
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短)可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用(或催化剂)的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究.实验一:甲同学利用Al、Fe、Mg和2mol/L的稀硫酸,设计实验方案研究影响反应速率的因素.
研究的实验报告如表:
| 实验步骤 | 现象 | 结论 |
| ①分别取等体积的2mol/L的硫酸于试管中;②分别投入大小、形状相同的Al、Fe、Mg | 反应快慢:Mg>Al>Fe | 反应物的性质越活泼,反应速率越快 |
要得出正确的实验结论,还需控制的实验条件是温度相同.
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用如图装置同温下进行定量实验,用大小形状相同的Fe分别和0.5mol/L及2mol/L的足量稀H2SO4反应,通过测定和比较同时间内产生氢气的体积(或测定比较产生同体积氢气所需时间的长短)可以说明浓度对化学反应速率的影响.
实验二:已知2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+8H2O+10CO2↑,在开始一段时间内,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快.
(1)针对上述现象,某同学认为该反应放热,导致溶液温度上升,反应速率加快.从影响化学反应速率的因素看,你猜想还可能是Mn2+的催化作用(或催化剂)的影响.
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液外,可以在反应一开始时加入B.
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水.
11.在一定条件下RO3-与R-发生如下反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R的叙述中正确的是( )
| A. | R为ⅤA族元素 | |
| B. | R的氢化物的水溶液属于强酸 | |
| C. | 氧化剂与还原剂的物质的量之比为5:1 | |
| D. | R2在常温常压下一定是气体 |