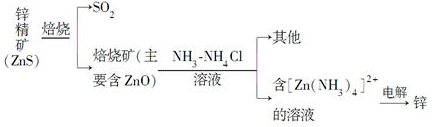
题目内容
12.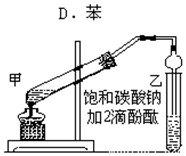 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下:①在甲试管(如图)中加入2mL浓硫酸、3mL乙醇和2mL乙酸的混合溶液.
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀地加热3~5min.
③待试管乙收集到一定量产物后停止加热,撤出试管并用力振荡,然后静置待分层.④分离出乙酸乙酯层、洗涤、干燥.
(1)反应中浓硫酸的作用是催化剂和吸水剂
(2)甲试管中混合溶液的加入顺序:先加乙醇,再加浓硫酸,最后加乙酸;
(3)上述实验中饱和碳酸钠溶液的作用是(填字母):BC.
A.中和乙酸和乙醇. B.中和乙酸并吸收部分乙醇.
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
D.加速酯的生成,提高其产率.
(4)欲将乙试管中的物质分离开以得到乙酸乙酯,必须使用的仪器有分液漏斗;分离时,乙酸乙酯应该从仪器上口倒 (填:“下口放”或“上口倒”)出.
(5)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
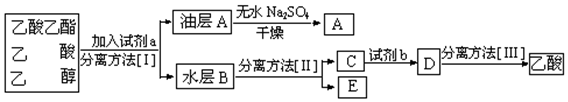
则试剂a是:饱和碳酸钠溶液分离方法I是分液分离方法II是蒸馏试剂b是硫酸,分离方法III是蒸馏.
(6)甲、乙两位同学欲将所得含有乙醇、乙酯和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出.甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物乙得到了大量水溶性的物质
丙同学分析了上述实验目标产物后认为上述实验没有成功.
试解答下列问题:
①甲实验失败的原因是:所加的NaOH溶液较少,没有将余酸中和
②乙实验失败的原因是:所加NaOH溶液过量,酯彻底水解.
分析 (1)依据浓硫酸性质分析其在反应中的作用;
(2)浓硫酸稀释放热,为防止酸液飞溅,应先加入乙醇,然后在加入浓硫酸和乙酸;
(3)饱和碳酸钠溶液与乙酸反应除去乙酸、同时降低乙酸乙酯的溶解度,便于分层;
(4)乙酸乙酯不溶于碳酸钠溶液,可以通过分液操作分离;乙酸乙酯的密度较小,从分液漏斗的上口倒出;
(5)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸;
(6)①根据甲得到了显酸性的酯的混合物,说明加入的氢氧化钠溶液不足进行分析;
②根据乙酸乙酯能够与氢氧化钠溶液发生水解分析失败原因.
解答 解:(1)浓硫酸具有吸水性,在酯化反应中起:催化剂和吸水剂的作用,故答案为:催化剂和吸水剂;
(2)浓硫酸密度比水大,溶于水放出大量的热,为防止酸液飞溅,加入药品时应先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最后再加入乙酸,
故答案为:先加乙醇,再加浓硫酸,最后加乙酸;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:BC;
(4)乙酸乙酯不溶于碳酸钠溶液,乙酸乙酯遇碳酸钠溶液,混合液会分层,可以通过分液操作分离出乙酸乙酯,使用到的主要仪器为分液漏斗;由于乙酸乙酯密度小于碳酸钠溶液,分液时从分液漏斗的上口倒出,
故答案为:分液漏斗;上口倒;
(5)分离粗产品乙酸乙酯、乙酸和乙醇的混合物,加入试剂a为饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离为操作I,则操作I为分液;乙酸钠与乙醇分离,为操作II,因二者沸点不同,采取蒸馏法;然后C中乙酸钠加试剂b为硫酸将乙酸钠转化成乙酸,再通过蒸馏将乙酸分离,即操作Ⅲ为蒸馏,
故答案为:饱和碳酸钠溶液;分液;蒸馏;硫酸;蒸馏;
(6)①甲得到显酸性的酯的混合物,酸有剩余,说明是所加NaOH溶液不足未将酸完全反应,
故答案为:所加的NaOH溶液较少,没有将余酸中和;
②乙得到大量水溶性物质,说明没有酯,是因为所加NaOH溶液过量,酯发生水解,且彻底水解,
故答案为:所加NaOH溶液过量,.
点评 本题考查乙酸乙酯的制取以及有有机物的分离提纯实验方案的设计,把握发生的反应和流程中的操作为解答的关键,明确物质分离与提纯常用的方法,熟悉分液操作与蒸馏操作各适用于分离的混合物类型及正确操作方法即可解答,题目难度中等.

| A. | 化学反应中1 mol金属镁变成镁离子时失去电子的数目为2NA | |
| B. | 28 g氮气所含有的原子数目为NA | |
| C. | 标准状况下,22.4 L水中含有NA个水分子 | |
| D. | 标准状况下,22.4 L氯化氢所含的原子数为NA |
| A. | 一种化合物 | B. | 两种酸性氧化物 | ||
| C. | 两种化合物 | D. | 一种单质和一种化合物的混合物 |
| A. | Cl2是氧化剂,KOH是还原剂 | |
| B. | KOH是氧化剂,Cl2是还原剂 | |
| C. | KCl是还原产物,KClO3是氧化产物 | |
| D. | 被氧化的氯原子与被还原的氯原子数之比为5:1 |
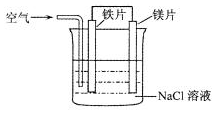
| A. | 镁片为负极,镁片上产生黄绿色气体 | |
| B. | 铁片为阳极,铁片上产生无色气体 | |
| C. | 溶液中铁片与镁片之间产生白色沉淀 | |
| D. | 溶液的pH将逐渐增大 |
| 物质 | 杂质 | 除杂试剂或操作方法 | |
| A | CuSO4 | FeSO4 | 加入过量铁粉,过滤 |
| B | NaNO3 | CaCO3 | 溶解、过滤 |
| C | CO2 | O2 | 通入NaOH溶液,洗气 |
| D | KNO3溶液 | AgNO3 | 加入NaCl溶液,过滤 |
| A. | A | B. | B | C. | C | D. | D |
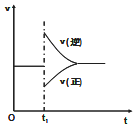 在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:
在一定条件下,向一带活塞的密闭容器中充入2mol A和1mol B,发生下列反应:2A(g)+B(g)?2C(g)△H<0.达到平衡后,在t1时刻改变条件,化学反应速率随时间变化如图.下列对t1时刻改变条件的推测中正确的是( )
| A. | 保持压强不变,升高反应温度 | |
| B. | 保持温度不变,增大容器体积 | |
| C. | 保持温度和容器体积不变,充入1 mol C(g) | |
| D. | 保持温度和压强不变,充入1 mol C(g) |