题目内容
4.关于如图装置的叙述,正确的是( )
| A. | 镁片为负极,镁片上产生黄绿色气体 | |
| B. | 铁片为阳极,铁片上产生无色气体 | |
| C. | 溶液中铁片与镁片之间产生白色沉淀 | |
| D. | 溶液的pH将逐渐增大 |
分析 该装置是原电池,镁片作负极,铁片作正极,负极上镁失电子发生氧化反应生成镁离子,正极上氧气得电子发生还原反应生成氢氧根离子,镁离子和氢氧根离子反应生成难溶性的氢氧化镁.
解答 解:该装置是原电池,镁片作负极,铁片作正极,
A.镁片为负极,负极上镁失电子发生氧化反应生成镁离子,故A错误;
B.铁片作正极,正极上氧气得电子发生还原反应生成氢氧根离子,电极反应式为:2H2O+O2+4e-=4OH-,故B错误;
C.负极上的电极反应式为:2Mg-4e-=2Mg 2+,正极上的电极反应式为:2H2O+O2+4e-=4 OH-,镁离子和氢氧根离子反应生成难溶性的氢氧化镁,故C正确;
D.由负极上的电极反应式为:2Mg-4e-=2Mg 2+,正极上的电极反应式为:2H2O+O2+4e-=4 OH-,所以总反应为2Mg+2H2O+O2=2Mg(OH)2↓,所以溶液的pH基本不变,故D错误;
故选C.
点评 本题考查原电池原理,明确正负极上发生的反应是解本题的关键,易错选项是D,根据总反应确定溶液的pH,为易错点.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
5.化学方程式为3MnO2+6KOH+KClO3$\frac{\underline{\;\;△\;\;}}{\;}$3K2MnO4+KCl+3H2O,下列说法中正确的( )
| A. | 反应中MnO2是氧化剂 | |
| B. | 该反应属于复分解反应 | |
| C. | KClO3在反应中失去电子 | |
| D. | 反应中每生成l mol K2MnO4,氧化剂得到2 mol电子 |
16.下列各物质所含原子数目,按由大到小顺序排列的是( )
①0.5mol NH3 ②标准状况下22.4L He ③4℃9mL水 ④19.6g H3PO4.
①0.5mol NH3 ②标准状况下22.4L He ③4℃9mL水 ④19.6g H3PO4.
| A. | ①④③② | B. | ④③②① | C. | ②③④① | D. | ①④②③ |
13.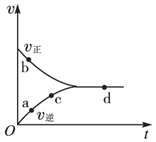 一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
 一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )
一定条件下,向密闭容器中充入1mol NO和1mol CO进行反应:NO(g)+CO(g)?$\frac{1}{2}$N2(g)+CO2(g),测得化学反应速率随时间的变化关系如图所示,其中处于化学平衡状态的点是( )| A. | a点 | B. | b点 | C. | c点 | D. | d点 |
12.以下是25℃时几种难溶电解质的溶解度:
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子.例如:
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
①为了除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为了除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为了除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=4,过滤结晶即可.
请回答下列问题:
(1)上述三个除杂方案都能够达到很好效果,Fe3+、Fe2+都被转化为Fe(OH)3(填化学式)而除去.
(2)①中加入的试剂应该选择氨水为宜,其原因是不会引入新的杂质.
(3)②中除去Fe3+所发生的总反应的离子方程式为2Fe3++3Mg(OH)2=3Mg2++2Fe(OH)3.
(4)下列与方案③相关的叙述中,正确的是ACDE(填字母).
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=4可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=4的溶液中
E.在pH>4的溶液中Fe3+一定不能大量存在.
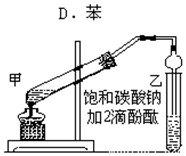 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: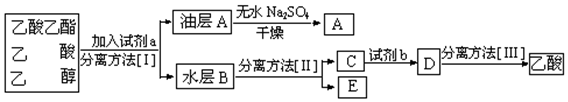
 产物不稳定,受热即脱水而生成不饱和醛.
产物不稳定,受热即脱水而生成不饱和醛.
 ;F
;F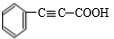 .
. +CH3CHO$\stackrel{△}{→}$
+CH3CHO$\stackrel{△}{→}$ +2NaOH$→_{△}^{乙醇}$
+2NaOH$→_{△}^{乙醇}$