题目内容
12.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )| A. | 化学反应中1 mol金属镁变成镁离子时失去电子的数目为2NA | |
| B. | 28 g氮气所含有的原子数目为NA | |
| C. | 标准状况下,22.4 L水中含有NA个水分子 | |
| D. | 标准状况下,22.4 L氯化氢所含的原子数为NA |
分析 A、镁变为镁离子时失去2个电子;
B、氮气由氮原子构成;
C、标况下,水为液态;
D、求出HCl的物质的量,然后根据HCl为双原子分子来分析.
解答 解:A、镁变为镁离子时失去2个电子,故1mol镁失去2NA个电子,故A正确;
B、氮气由氮原子构成,故28g氮气中含2mol氮原子即2NA个,故B错误;
C、标况下,水为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、标况下22.4LHCl的物质的量为1mol,而HCl为双原子分子,故1molHCl中含2NA个原子,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.下列物质中均为化合物的一组是( )
| A. | 铜、CaO、SO2 | B. | KCl、盐酸、NaOH | ||
| C. | CuSO4•5H2O、冰、乙醇 | D. | O3、CaCO3、空气 |
17.已知在25℃时,下列反应的平衡常数如下:
①N2(g)+O2(g)??2NO(g) K1=1×10-30
②2H2(g)+O2(g)?2H2O(g) K2=2×1081
③2CO2(g)?2CO(g)+O2(g) K3=4×10-92
下列说法正确的是( )
①N2(g)+O2(g)??2NO(g) K1=1×10-30
②2H2(g)+O2(g)?2H2O(g) K2=2×1081
③2CO2(g)?2CO(g)+O2(g) K3=4×10-92
下列说法正确的是( )
| A. | NO分解反应NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)的平衡常数为1×10-30 | |
| B. | 根据K2的值可以判断常温下H2和O2很容易反应生成H2O | |
| C. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2 | |
| D. | 温度升高,上述三个反应的平衡常数均增大 |
 .
.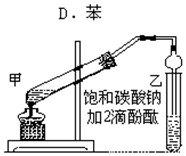 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: