题目内容
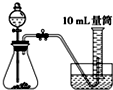
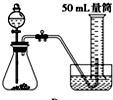
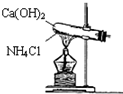 实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:
实验室通常用如图所示的装置来制取氨气,(收集装置略).回答下列问题:(1)氨是一种重要的化工产品,通常是
(填“大”或“小”),
(2)如果用烧瓶收集氨气,如何检验氨气是否收集满(简述操作方法、现象和结论)?
(3)加热后将蘸有浓盐酸的玻璃棒靠近导管口,产生的现象是
(4)写出实验室用该方法制取氨气的化学方程式
考点:氨的实验室制法,实验装置综合
专题:实验设计题
分析:(1)氨气有刺激性气味,密度比空气的小,极易溶于水;
(2)氨气遇到湿润的红色石蕊试纸,试纸变蓝;
(3)氨气遇到氯化氢会产生白烟;
(4)实验室用加热氢氧化钙和氯化铵的方法制取氨气.
(2)氨气遇到湿润的红色石蕊试纸,试纸变蓝;
(3)氨气遇到氯化氢会产生白烟;
(4)实验室用加热氢氧化钙和氯化铵的方法制取氨气.
解答:
解:(1)氨气通常是无色,有刺激性气味,密度比空气的小,极易溶于水的气体,故答案为:无;刺激性;小;易;
(2)氨气遇到湿润的红色石蕊试纸,试纸变蓝,所以用湿润的红色石蕊试纸靠近试管口,试纸变蓝,则说明氨气已收满;
故答案为:湿润的红色石蕊试纸靠近试管口,试纸变蓝;
(3)氨气遇到氯化氢会生成氯化铵固体,所以有白烟生成,故答案为:产生白烟;
(4)实验室用加热氢氧化钙和氯化铵的方法制取氨气,加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为Ca(OH)2+2NH4Cl
CaCl2 +2H2O+2NH3↑,故答案为:Ca(OH)2+2NH4 Cl
CaCl2 +2H2O+2NH3↑.
(2)氨气遇到湿润的红色石蕊试纸,试纸变蓝,所以用湿润的红色石蕊试纸靠近试管口,试纸变蓝,则说明氨气已收满;
故答案为:湿润的红色石蕊试纸靠近试管口,试纸变蓝;
(3)氨气遇到氯化氢会生成氯化铵固体,所以有白烟生成,故答案为:产生白烟;
(4)实验室用加热氢氧化钙和氯化铵的方法制取氨气,加热条件下,氯化铵和氢氧化钙反应生成氯化钙、氨气和水,反应方程式为Ca(OH)2+2NH4Cl
| ||
| ||
点评:本题考查了实验室氨气的制取及氨气的性质,把握反应原理、实验现象、实验基本操作是解题的关键,题目较简单.

练习册系列答案
 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
已知Ksp(FeS)=6.3×10-18,Ksp(CuS)=6.3×10-36,K1(H2S)=1.3×10-20. 向0.10mol?L-1Fe2+和0.10mol?L-1Cu2+的混合溶液中通入H2S气体至饱和(c(H2S) 0.10mol?L-1).请推断沉淀生成情况是下列哪一种( )
| A、先生成CuS 沉淀,后生成FeS 沉淀 |
| B、先生成FeS 沉淀,后生成CuS 沉淀 |
| C、先生成CuS 沉淀,不生成FeS 沉淀 |
| D、先生成CuS 沉淀,反应一段时间FeS和CuS同时沉淀 |
将气体A2和B2各1mol注入容积为1L的密闭容器中反应生成C,平衡时测得c(A2)=0.58mol/L,则c(B2)=0.16mol/L,c(C)=0.84mol/L,则C的分子式为( )
| A、AB2 |
| B、A2B4 |
| C、AB |
| D、A2B |
存放下列试剂的方法中,有错误并且会引起危险的是( )
| A、白磷浸在盛有CS2的敞口试剂瓶中 |
| B、金属钠浸在盛有煤油的试剂瓶中 |
| C、浓硝酸存放在棕色试剂瓶中 |
| D、溴水放在带玻璃塞的试剂瓶中 |
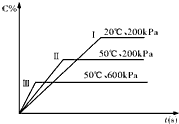 在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )
在密闭容器中进行以下可逆反应:A(g)+B(g)?C(g)+2D(?),在不同的条件下C的百分含量的变化情况如如图,则该反应描述正确的是( )| A、正反应放热,D是固体 |
| B、正反应放热,D是气体 |
| C、正反应吸热,D是气体 |
| D、正反应放热,D是固体或气体 |
 表示不同的一个原子,球与球之间的连线代表化学键,如单键、双键等).
表示不同的一个原子,球与球之间的连线代表化学键,如单键、双键等).
