题目内容
17.一定量的混合气体在密闭容器中发生反应:mA(g)+nB(g)?pC(g)达到平衡时,维持温度不变,将气体体积缩小到原来的$\frac{1}{2}$,当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,则下列说法正确的是( )| A. | m+n>p | B. | m+n<p | ||
| C. | 平衡向正反应方向移动 | D. | C的质量分数增加 |
分析 将气体体积缩小到原来的$\frac{1}{2}$,若平衡不移动,气体C的浓度变为原平衡时的2倍,而当达到新的平衡时,气体C的浓度变为原平衡时的1.9倍,可知增大压强,平衡逆向移动,以此来解答.
解答 解:A.由上述分析可知,增大压强,平衡逆向移动,可知m+n<p,故A错误;
B.增大压强,平衡逆向移动,m+n<p,故B正确;
C.增大压强,平衡逆向移动,故C错误;
D.平衡逆向移动,C的质量分数减小,故D错误;
故选B.
点评 本题考查化学平衡移动,为高频考点,把握压强对平衡移动的影响为解答的关键,侧重分析与应用能力的考查,注意动态与静态变化的结合,题目难度不大.

练习册系列答案
相关题目
8.pC类似pH,是指稀溶液中溶质物质的量浓度的常用对数负值.如某溶液溶质的浓度为:1×10-3mol•L-1,则该溶液中溶质的pC=3.下列叙述正确的是( )
| A. | 常温下,0.01mol•L-1的醋酸溶液中,pC(H+)=2 | |
| B. | 常温下,向0.01mol•L-1的氨水中加入等体积等浓度的盐酸,混合液的pC(H+)<7 | |
| C. | 100℃时,0.01mol•L-1的NaOH溶液中,pC(OH-)+pC(H+)=14 | |
| D. | 100℃时,CaCO3的Ksp=2.5×10-9,其饱和溶液中pC(Ca2+)+pC(CO32-)=9 |
5.在一定温度下,相一个容积固定的密闭容器中充入2molSO2和1molO2,发生反应2SO2(g)+O2(g)?2SO3(g),反应达到平衡时,测得SO3的浓度为c mol•L-1,若起始时按下列比例配料,则平衡时SO3仍为cmol•L-1的是( )
| A. | 1molSO2、0.5molO2、1molSO3 | B. | 4molSO2、2molO2 | ||
| C. | 4molSO3 | D. | 1molSO2、1molO2、1molSO3 |
2.实验是化学研究的基础,如图装置或操作正确的是( )
| A. | 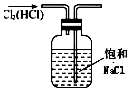 用图所示装置可得到纯净的Cl2 | |
| B. | 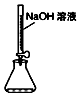 用图量取15.00mL的NaOH溶液 | |
| C. | 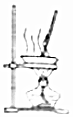 用图所示装置蒸发FeCl3溶液制备无水FeCl2 | |
| D. |  关闭分液漏斗的活塞,从b处加水,以检查装置的气密性 |
9.下列离子方程式书写正确的是( )
| A. | AlCl3溶液与过量的氨水反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 过量的澄清石灰水与碳酸氢钠溶液反应:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| C. | 硫酸与Ba(OH)2溶液反应:H++OH-=H2O | |
| D. | FeCl3溶液与Fe反应:Fe3++Fe=2Fe2+ |
6.相同温度下等物质的量浓度的下列溶液中,c(NH4+)最大的是( )
| A. | CH3COONH4 | B. | NH3•H2O | C. | NH4Cl | D. | NH4HSO4 |
7.在隔绝空气的条件下发生反应:CH4(g)=C(g)+2H2(g)△H>0,下列说法正确的是( )
| A. | 低温下是非自发反应,高温下是自发反应 | |
| B. | 任何温度下都是自发反应 | |
| C. | 低温下是自发反应,高温下是非自发反应 | |
| D. | 任何温度下都是非自发反应 |
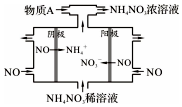 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.