题目内容
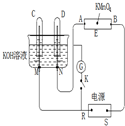 如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.
如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.(1)外电源中,R为
(2)A附近溶液的现象是
(3)滤纸上的紫色点移动的方向是
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,经一段时间,C、D气体均逐渐减少,主要因为
考点:原电池和电解池的工作原理
专题:
分析:(1)根据C、D两电极得到的气体体积判断电极名称,从而确定电源R、S电极名称;
(2)先判断A、B 的电极名称,根据电解池的工作原理来书写电极反应式;
(3)根据电解池的工作原理判断电解时溶液中离子的移动方向;
(4)根据原电池中燃料电池的工作原理和规律来回答;
(2)根据电池反应式知,负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,根据电池反应式确定溶液中硫酸浓度变化;根据负极上增加质量与转移电子之间的关系式计算负极板增加的质量.
(2)先判断A、B 的电极名称,根据电解池的工作原理来书写电极反应式;
(3)根据电解池的工作原理判断电解时溶液中离子的移动方向;
(4)根据原电池中燃料电池的工作原理和规律来回答;
(2)根据电池反应式知,负极电解反应:Pb-2e-+SO42-=PbSO4 ,正极电极反应:PbO2+2e-+4H++2SO42-=PbSO4+2H2O,根据电池反应式确定溶液中硫酸浓度变化;根据负极上增加质量与转移电子之间的关系式计算负极板增加的质量.
解答:
解:(1)闭合K,通直流电,电极C、D及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,C极上气体体积是D极上气体体积的2倍,所以C极上得氢气,D极上得到氧气,故R是负极,S是正极,所以B极是阳极,A极是阴极.
故答案为:负;正;
(2)A极是阴极,电解高锰酸钾时,在该极上放电的是氢离子,所以该极上碱性增强,酚酞显红色,B极是阳极,该极附近发生的电极反应式为:4OH--4e-=2H2O+O2↑,故答案为:溶液变红;4OH--4e-=2H2O+O2↑;
(3)浸有高锰酸钾的滤纸和电极A、B与电源也构成了电解池,因为R是负极,S是正极,所以B极是阳极,A极是阴极,电解质溶液中的阴离子高锰酸跟离子向阳极移动,所以B极呈紫色,
故答案为:紫色向B方向移动;
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,构成氢氧燃料电池,在燃料电池中,燃料氢气为负极,方程式为2H2+4OH--4e-=4H2O;
氧气作正极,方程式为O2+2H2O+4e-=4OH-;
故答案为:氢气和氧气构成燃料电池;2H2+4OH--4e-=4H2O;O2+2H2O+4e-=4OH-;
故答案为:负;正;
(2)A极是阴极,电解高锰酸钾时,在该极上放电的是氢离子,所以该极上碱性增强,酚酞显红色,B极是阳极,该极附近发生的电极反应式为:4OH--4e-=2H2O+O2↑,故答案为:溶液变红;4OH--4e-=2H2O+O2↑;
(3)浸有高锰酸钾的滤纸和电极A、B与电源也构成了电解池,因为R是负极,S是正极,所以B极是阳极,A极是阴极,电解质溶液中的阴离子高锰酸跟离子向阳极移动,所以B极呈紫色,
故答案为:紫色向B方向移动;
(4)当C、D里的气体产生到一定量时,切断外电源并接通开关K,构成氢氧燃料电池,在燃料电池中,燃料氢气为负极,方程式为2H2+4OH--4e-=4H2O;
氧气作正极,方程式为O2+2H2O+4e-=4OH-;
故答案为:氢气和氧气构成燃料电池;2H2+4OH--4e-=4H2O;O2+2H2O+4e-=4OH-;
点评:本题考查了原电池、电解池工作原理,会根据电池反应式及元素化合价变化书写正负极电极反应式,再结合各个物理量之间的关系式进行计算,题目难度中等.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
在常温常压下,下列各组气体不能共存的是( )
| A、SO2与O2 |
| B、HCl与NH3 |
| C、O2与N2 |
| D、C12与HI |
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB=Na++HB-,②HB-≒H++B2-,③HB-+H2O≒H2B+OH-且溶液中c(H+)>c(OH-),则下列说法错误的是( )
| A、NaHB为强电解质 |
| B、NaHB溶液中:c(Na+)>c(HB-)+2c(B2-) |
| C、H2B为弱电解质 |
| D、HB-的电离程度小于HB-的水解程度 |
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
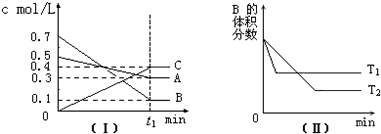

| A、在 t1时间内用B表示该反应的平均速率为0.4/t1mol?L-1?min-1 |
| B、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| C、T℃时,在相同容器中,若由0.3mol?L-1A、0.1 mol?L-1 B和0.4 mol?L-1 C反应,达到平衡后,C的浓度仍为0.4 mol?L-1 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
下列叙述中能肯定判断某化学平衡发生移动的是( )
| A、反应混合物的浓度的改变 |
| B、反应混合物中各组分的含量的改变 |
| C、正、逆反应速率的改变 |
| D、反应物的转化率的改变 |
对于xA(g)+yB(g)?zC(g)+wD(g)的平衡体系,当升高温度时,体系的平均相对分子质量从26变为29,则下列说法中正确的是( )
| A、x+y>z+w,正反应是放热反应 |
| B、x+y>z+w,正反应是吸热反应 |
| C、x+y<z+w,逆反应是放热反应 |
| D、x+y<z+w,正反应是吸热反应 |