题目内容
已知多元弱酸在水溶液中的电离是分步进行的,且第1步电离程度大于第2步,第2步电离程度大于第3步…今有HA、H2B、H3C 三种弱酸,根据“较强酸+较弱酸盐=较强酸盐+较弱酸”的反应规律,它们之间能发生反应:①HA+HC2-(少量)=A-+H2C,②H2B(少量)+2A=B2-+2HA,③H2B(少量)+H2C-=HB-+H3C,请回答下列问题:
(1)在相同条件下,HA、H2B、H3C 3种酸中酸性最强的是 .
(2)在A-、B2-、C3-、HB-、H2C-、HC2-6种离子中,最易结合质子的是 ,最难结合质子的是 .
(3)写出离子方程式:①H3C与OH-(过量) ;②HA(过量)与C3- .
(1)在相同条件下,HA、H2B、H3C 3种酸中酸性最强的是
(2)在A-、B2-、C3-、HB-、H2C-、HC2-6种离子中,最易结合质子的是
(3)写出离子方程式:①H3C与OH-(过量)
考点:弱电解质在水溶液中的电离平衡,离子方程式的书写
专题:
分析:首先,根据题目中的信息,判断酸性顺序:第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度,得到
H2B>HB-、H3C>H2C->HC2-,它们之间能发生下列反应,得到
①HA+HC2-(少量)=A-+H2C-
即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,
②H2B(少量)+2A-=2HA+B2-
即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,
即说明H2B>HB->HA
③H2B(少量)+H2C-=HB-+H3C
即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-,
综合得到H2B>H3C>HB->HA>H2C->HC2-,然后利用这个顺序进行判断.
H2B>HB-、H3C>H2C->HC2-,它们之间能发生下列反应,得到
①HA+HC2-(少量)=A-+H2C-
即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,
②H2B(少量)+2A-=2HA+B2-
即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,
即说明H2B>HB->HA
③H2B(少量)+H2C-=HB-+H3C
即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-,
综合得到H2B>H3C>HB->HA>H2C->HC2-,然后利用这个顺序进行判断.
解答:
解:(1)根据题目中的信息,判断酸性顺序:第一步电离程度远大于第二步电离程度,第二步电离程度远大于第三步电离程度,得到
H2B>HB-H3C>H2C->HC2-它们之间能发生下列反应,
①HA+HC2-(少量)=A-+H2C-,即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,
②H2B(少量)+2A-=2HA+B2-,即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,
即说明H2B>HB->HA,
③H2B(少量)+H2C-=HB-+H3C,
即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-,
综合信息得到H2B>H3C>HB->HA>H2C->HC2-,所以最强的酸为H2B,故答案为:H2B;
(2)由以上酸性强弱顺序知:物质的酸性越强,其对应酸根离子结合质子的能力越弱,反之越强,所以最易结合质子的是C3-,最难结合质子的是HB-.
故答案为:C3-;HB-;
(3)①过量的氢氧根离子能够将酸中的氢离子完全中和,所以其反应的离子方程式为:H3C+3HO-=3H2O+C3-,故答案为:H3C+3HO-=3H2O+C3-;
②根据H2B>H3C>HB->HA>H2C->HC2-,以及强酸制弱酸的原则,过量HA与C3-反应的离子方程式为:2HA+C3-=2A-+H2C-,故答案为:2HA+C3-=2A-+H2C.
H2B>HB-H3C>H2C->HC2-它们之间能发生下列反应,
①HA+HC2-(少量)=A-+H2C-,即HA>H2C-,同时,即使HA过量,也只能生成H2C-,而不是H3C,说明HA<H3C,
②H2B(少量)+2A-=2HA+B2-,即H2B>HA,同时,由于H2B很少,并生成B2-,即说明H2B将2个H+都给了A-,即HB-也能将H+给A-,
即说明H2B>HB->HA,
③H2B(少量)+H2C-=HB-+H3C,
即H2B>H3C,但是生成HB-,即说明HB-不能将H+提供,即HB-<H3C,即H2B>H3C>HB-,
综合信息得到H2B>H3C>HB->HA>H2C->HC2-,所以最强的酸为H2B,故答案为:H2B;
(2)由以上酸性强弱顺序知:物质的酸性越强,其对应酸根离子结合质子的能力越弱,反之越强,所以最易结合质子的是C3-,最难结合质子的是HB-.
故答案为:C3-;HB-;
(3)①过量的氢氧根离子能够将酸中的氢离子完全中和,所以其反应的离子方程式为:H3C+3HO-=3H2O+C3-,故答案为:H3C+3HO-=3H2O+C3-;
②根据H2B>H3C>HB->HA>H2C->HC2-,以及强酸制弱酸的原则,过量HA与C3-反应的离子方程式为:2HA+C3-=2A-+H2C-,故答案为:2HA+C3-=2A-+H2C.
点评:本题综合考查弱电解质的电离问题,题目较难,做题时注意把握“较强酸+较弱酸盐→较强酸盐+较弱酸”的反应规律.

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目
已知相同条件下,I-的还原性强于Fe2+.在某酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向溶液中加入溴水和淀粉,溶液变蓝,由此可推断溶液中( )
| A、一定含有I-,不能确定是否含有Cl- |
| B、可能含有Cl-、NO3-和I- |
| C、可能含有NO3- |
| D、一定不含有Fe3+ |
某酯的化学式为C5H10O2,把它与氢氧化钠溶液共热产生不发生消去反应的一元醇,该酯的名称是( )
| A、丁酸甲酯 | B、甲酸丁酯 |
| C、乙酸丙酯 | D、丙酸乙酯 |
下列烷烃的一氯取代物种没有同分异构体的是( )
| A、丙烷 | B、乙烷 |
| C、2-甲基丁烷 | D、3-甲基戊烷 |
下列不能组成缓冲溶液的是( )
| A、盐酸和氯化钠 |
| B、氨水和氯化铵 |
| C、苏打和小苏打 |
| D、醋酸和醋酸钠 |
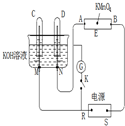 如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.
如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.