题目内容
用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向某密闭的真空容器(假设容器体积不变,固体试样体积忽略不计)中加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如表:
①10min~20min以v(CO2)表示的反应速率为 .
②该反应的平衡常数的表达式为K= ,根据表中数据,计算T1℃时该反应的平衡常数为 (保留两位小数).
③下列各项能作为判断该反应达到平衡的是 (填序号字母).
a.容器内压强保持不变
b.2v(NO)正=v(N2)逆
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率 (填“增大”“不变”或“减小”).
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②该反应的平衡常数的表达式为K=
③下列各项能作为判断该反应达到平衡的是
a.容器内压强保持不变
b.2v(NO)正=v(N2)逆
c.容器内CO2的体积分数不变
d.混合气体的密度保持不变
④一定温度下,随着NO的起始浓度增大,则NO的平衡转化率
考点:化学平衡的计算,反应速率的定量表示方法,化学平衡的影响因素,化学平衡状态的判断
专题:
分析:①由图表数据分析,结合反应速率概念计算得到,v=
;
②20min-30min反应达到平衡,图表中平衡浓度,依据平衡常数的概念计算得到;
③依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断;
④反应是气体体积不变的反应,反应物只有气体一氧化氮,增大一氧化氮浓度相当于增大容器内压强对平衡的影响分析.
| △c |
| △t |
②20min-30min反应达到平衡,图表中平衡浓度,依据平衡常数的概念计算得到;
③依据化学平衡状态的实质是正逆反应速率相等,结合反应特征分析判断;
④反应是气体体积不变的反应,反应物只有气体一氧化氮,增大一氧化氮浓度相当于增大容器内压强对平衡的影响分析.
解答:
解:①10min~20min以v(CO2) 表示的反应速率=
=0.009 mol?L-1?min-1,故答案为:0.009 mol?L-1?min-1;
②20-30min反应达到平衡状态,C(s)+2NO(g)?N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.3mol/L;c(NO)=0.4mol/L,反应的平衡常数为:K=
=
=0.56,故答案为:
,0.56;
③C(s)+2NO(g)?N2(g)+CO2(g)反应是气体体积不变的反应;
a.反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故a错误;
b.反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,故b错误;
c.容器内CO2的体积分数不变,说明反应达到平衡,故c正确;
d.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故d正确;
故选cd;
④一定温度下,随着NO的起始浓度增大,C(s)+2NO(g)?N2(g)+CO2(g)反应是气体体积不变的反应;增大一氧化氮浓度相当于增大体系压强,平衡不移动,一氧化氮转化率不变,故答案为:不变.
| 0.30mol/L-0.21mol/L |
| 10min |
②20-30min反应达到平衡状态,C(s)+2NO(g)?N2 (g)+CO2 (g),各物质的平衡浓度为:c(CO2)=c(N2)=0.3mol/L;c(NO)=0.4mol/L,反应的平衡常数为:K=
| c(CO2)c(N2) |
| c2(NO) |
| 0.3×0.3 |
| 0.42 |
| c(CO2)c(N2) |
| c2(NO) |
③C(s)+2NO(g)?N2(g)+CO2(g)反应是气体体积不变的反应;
a.反应是气体体积不变的反应,反应过程中和反应平衡状态压强相同,所以容器内压强保持不变不能说明反应达到平衡,故a错误;
b.反应速率之比等于化学方程式系数之比,当v正(NO)=2v逆(N2),反应达到平衡,故b错误;
c.容器内CO2的体积分数不变,说明反应达到平衡,故c正确;
d.混合气体密度等于质量除以体积,反应中碳是固体,平衡移动气体质量变化,体积不变,所以混合气体的密度保持不变,说明反应达到平衡,故d正确;
故选cd;
④一定温度下,随着NO的起始浓度增大,C(s)+2NO(g)?N2(g)+CO2(g)反应是气体体积不变的反应;增大一氧化氮浓度相当于增大体系压强,平衡不移动,一氧化氮转化率不变,故答案为:不变.
点评:本题较为综合,考查了速率计算、化学平衡常数、化学平衡状态的判断、化学平衡移动,难度中等.注意计算平衡常数要用平衡浓度.

练习册系列答案
相关题目
下列措施不利于节能减排、保护环境的是( )
| A、加快化石燃料的开采与使用 |
| B、研发易降解的生物农药 |
| C、应用高效洁净的能源转换技术 |
| D、发展煤的液化技术 |
下列烷烃的一氯取代物种没有同分异构体的是( )
| A、丙烷 | B、乙烷 |
| C、2-甲基丁烷 | D、3-甲基戊烷 |
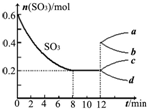 在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示: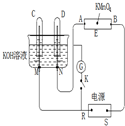 如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.
如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.
 (R为烷基,X为卤素原子)②RCH2CH2OH
(R为烷基,X为卤素原子)②RCH2CH2OH