题目内容
试简述在FeSO4溶液中加入NaOH溶液时的反应现象 写出有关反应的反应方程式① ② .
考点:化学方程式的书写,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:FeSO4溶液中加入NaOH溶液,二者反应生成灰白色沉淀Fe(OH)2,Fe(OH)2不稳定,易被空气中氧气氧化生成红褐色沉淀Fe(OH)3,看到的现象是:先生成灰白色沉淀,立即转化为灰绿色,最终转化为红褐色,据此分析解答.
解答:
解:FeSO4溶液中加入NaOH溶液,二者反应生成灰白色沉淀Fe(OH)2,Fe(OH)2不稳定,易被空气中氧气氧化生成红褐色沉淀Fe(OH)3,看到的现象是:先生成灰白色沉淀,立即转化为灰绿色,最终转化为红褐色,涉及的反应方程式为FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:先生成灰白色沉淀,立即转化为灰绿色,最终转化为红褐色;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:先生成灰白色沉淀,立即转化为灰绿色,最终转化为红褐色;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题以铁的氢氧化物为载体考查化学方程式的书写,明确物质的性质是解本题关键,注意反应过程中发生的现象,知道铁离子、亚铁离子的检验方法、现象,为高考高频点.

练习册系列答案
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案
相关题目
下列说法不正确的是( )
| A、将氯化铁浓溶液和氢氧化钠浓溶液混合,能得到氢氧化铁胶体 |
| B、胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸 |
| C、利用丁达尔效应可以区分溶液和胶体 |
| D、浊液的分散质粒子直径大于l00nm,不能通过滤纸 |
升高温度反应速度加快的主要原因是( )
| A、活化分子的百分数增加 |
| B、活化能增加 |
| C、单位体积内分子总数增加 |
| D、分子运动速度加快 |
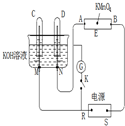 如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.
如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.