题目内容
T℃时,A气体与B气体反应生成C气体.反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
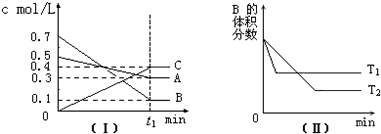

| A、在 t1时间内用B表示该反应的平均速率为0.4/t1mol?L-1?min-1 |
| B、在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 |
| C、T℃时,在相同容器中,若由0.3mol?L-1A、0.1 mol?L-1 B和0.4 mol?L-1 C反应,达到平衡后,C的浓度仍为0.4 mol?L-1 |
| D、其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 |
考点:体积百分含量随温度、压强变化曲线,物质的量或浓度随时间的变化曲线
专题:
分析:该反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.根据V=
进行计算;
B.增大压强,平衡向气体体积减小的方向移动;
C.先根据图Ⅰ计算平衡常数,再根据平衡常数计算改变三种物质的浓度达到平衡状态时C的浓度;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动.
根据“先拐先平数值大”结合图II知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.根据V=
| △c |
| △t |
B.增大压强,平衡向气体体积减小的方向移动;
C.先根据图Ⅰ计算平衡常数,再根据平衡常数计算改变三种物质的浓度达到平衡状态时C的浓度;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动.
解答:
解:反应达到平衡状态时,A浓度的变化量=(0.5-0.3)mol/L=0.2mol/L,B浓度的变化量=(0.7-0.1)mol/L=0.6mol/L,C浓度的变化量=(0.4-0)mol/L=0.4mol/L,同一化学反应同一时间段内,各物质浓度的变化量之比等于其计量数之比,所以该反应方程式为:A(g)+3B(g)?2C(g),
根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.在 t1时间内用B表示该反应的平均速率为
=
mol?L-1?min-1,故A错误;
B.该反应的正反应是气体体积减小的反应,(t1+10)min时,保持其他条件不变,增大压强,化学平衡向正反应方向移动,故B错误;
C.根据图Ⅰ知,化学平衡常数K=
=
,
假设C的平衡浓度是0.4mol/L,
A(g)+3B(g)?2C(g)
开始(mol/L)0.4 0.4 0.2
反应(mol/L)0.1 0.3 0.2
平衡(mol/L) 0.3 0.1 0.4
化学平衡常数K′=
=
,所以符合平衡常数K,故C正确;
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误;
故选:C.
根据“先拐先平数值大”结合图Ⅱ知,T1>T2,升高温度,B的体积发生增大,则该反应的正反应是放热反应;
A.在 t1时间内用B表示该反应的平均速率为
| 0.6mol/L |
| t 1 |
| 0.6 |
| t 1 |
B.该反应的正反应是气体体积减小的反应,(t1+10)min时,保持其他条件不变,增大压强,化学平衡向正反应方向移动,故B错误;
C.根据图Ⅰ知,化学平衡常数K=
| (0.4) 2 |
| 0.3×(0.1)3 |
| 1600 |
| 3 |
假设C的平衡浓度是0.4mol/L,
A(g)+3B(g)?2C(g)
开始(mol/L)0.4 0.4 0.2
反应(mol/L)0.1 0.3 0.2
平衡(mol/L) 0.3 0.1 0.4
化学平衡常数K′=
| (0.4) 2 |
| 0.3×(0.1)3 |
| 1600 |
| 3 |
D.其它条件不变,升高温度,正逆反应速率都增大,平衡向吸热反应方向移动,根据图Ⅱ知,正反应是放热反应,所以平衡向逆反应方向移动,A的转化率降低,故D错误;
故选:C.
点评:本题考查外界条件对化学平衡移动的影响,正确确定反应方程式是解本题关键,会根据“先拐先平数值大”确定该反应是吸热反应还是放热反应,难度中等.

练习册系列答案
相关题目
下列不能组成缓冲溶液的是( )
| A、盐酸和氯化钠 |
| B、氨水和氯化铵 |
| C、苏打和小苏打 |
| D、醋酸和醋酸钠 |
下列事实不能用勒夏特别原理解释的是( )
| A、加入催化剂能加快NH3转化为NO |
| B、配制FeCl3溶液时,向溶液中加入少量盐酸 |
| C、往醋酸溶液中加少量碱,有利于CH3COO-的增多 |
| D、往醋酸钠溶液中加入纯醋酸,可以抑制CH3COONa的水解 |
下列说法不正确的是( )
| A、将氯化铁浓溶液和氢氧化钠浓溶液混合,能得到氢氧化铁胶体 |
| B、胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸 |
| C、利用丁达尔效应可以区分溶液和胶体 |
| D、浊液的分散质粒子直径大于l00nm,不能通过滤纸 |
升高温度反应速度加快的主要原因是( )
| A、活化分子的百分数增加 |
| B、活化能增加 |
| C、单位体积内分子总数增加 |
| D、分子运动速度加快 |
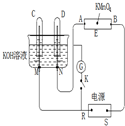 如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.
如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.