题目内容
已知酸式盐NaHB在水溶液中存在下列反应:①NaHB=Na++HB-,②HB-≒H++B2-,③HB-+H2O≒H2B+OH-且溶液中c(H+)>c(OH-),则下列说法错误的是( )
| A、NaHB为强电解质 |
| B、NaHB溶液中:c(Na+)>c(HB-)+2c(B2-) |
| C、H2B为弱电解质 |
| D、HB-的电离程度小于HB-的水解程度 |
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:盐类的水解专题
分析:NaHB是盐,完全电离为强电解质,HB-即电离又水解,c(H+)>c(OH-),说明电离程度大于水解程度,电离和水解程度都很小,所以溶液中c(Na+)和c(HB-)离子浓度大,c(B2-)很小,H2B是弱酸,据此解答.
解答:
解:A、NaHB是盐,完全电离为强电解质,故A正确;
B、HB-即电离又水解,电离和水解程度都很小,所以溶液中c(Na+)和c(HB-)离子浓度大,c(B2-)很小,故B正确;
C、H2B是弱酸为弱电解质,故C正确;
D、HB-即电离又水解,c(H+)>c(OH-),说明电离程度大于水解程度,故D错误;
故选D.
B、HB-即电离又水解,电离和水解程度都很小,所以溶液中c(Na+)和c(HB-)离子浓度大,c(B2-)很小,故B正确;
C、H2B是弱酸为弱电解质,故C正确;
D、HB-即电离又水解,c(H+)>c(OH-),说明电离程度大于水解程度,故D错误;
故选D.
点评:本题考查了弱酸的酸式盐的电离和水解,注意根据溶液的酸碱性判断电离和水解程度的大小,题目难度中等.

练习册系列答案
相关题目
下列化合物中,既能发生消去反应,又能发生水解反应的是( )
| A、三氯甲烷 | B、乙醇 |
| C、2-氯丙烷 | D、乙酸乙酯 |
下列不能组成缓冲溶液的是( )
| A、盐酸和氯化钠 |
| B、氨水和氯化铵 |
| C、苏打和小苏打 |
| D、醋酸和醋酸钠 |
下列说法不正确的是( )
| A、将氯化铁浓溶液和氢氧化钠浓溶液混合,能得到氢氧化铁胶体 |
| B、胶体的分散质粒子直径小于l00nm但大于1nm,能通过滤纸 |
| C、利用丁达尔效应可以区分溶液和胶体 |
| D、浊液的分散质粒子直径大于l00nm,不能通过滤纸 |
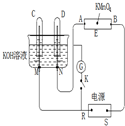 如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.
如图装置,E为蘸有Na2SO4溶液的滤纸,并加几滴酚酞.A、B分别为铂片,压在滤纸两端.R、S为电源的电极.M、N是用多微孔的镍棒作的电极材料,它在碱溶液中可视为惰性电极.G为电流计,K为开关.C、D和电解槽中均盛满浓KOH溶液.若在滤纸中央点上一滴紫色的KMnO4溶液,K断开,接通电源通电一段时间后,C、D中均有气体产生.