题目内容
7.已知还原性:Cl-<Br-<Fe2+<I-<SO2,由此判断下列反应必然发生的是( )①2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
②I2+SO2+2H2O=4H++SO42-+2I-
③2Fe2++I2=2Fe3++2I-
④2Br-+4H++SO42-=SO2↑+Br2+2H2O.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
分析 根据氧化还原反应中,还原剂的还原性强于还原产物的还原性规律来分析,如果给出的方程式中还原性顺序与题干中一致,则反应能够发生,否则反应不能进行.
解答 解:①2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,还原性大小为:SO2>Fe2+,与题干的还原性强弱一致,所以该反应能够发生,故①正确;
②I2+SO2+2H2O=4H++SO42-+2I-,还原性大小为:I-<SO2,与题干的还原性强弱一致,所以能发生,故②正确;
③2Fe2++I2=2Fe3++2I-,还原性大小为:Fe2+>I-,与题干的还原性强弱不一致,所以该反应不能发生,故③错误;
④2Br-+4H++SO42-=SO2↑+Br2+2H2O,还原性大小为:Br->SO2,与题干的还原性强弱不一致,所以该反应不能发生,故④错误;
则反应必然发生的是①②,
故选A.
点评 本题考查学生氧化还原反应的基本概念及氧化性还原性强弱的判断规律,题目难度中等,把握还原剂的还原性强于还原产物的还原性即可解答.

练习册系列答案
相关题目
1.下列各组中的性质比较,不正确的是( )
| A. | 水溶性:SO2>Cl2>CO2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 稳定性:NH3>H2O>HF | D. | 沸点:F2<Cl2<Br2<I2 |
15.乙醛(CH3CHO)、乙酸、乙酸乙酯三种有机物按一定比例组成的混合物中,若含氧的质量分数为A%,则此混合物中含氢的质量分数为( )
| A. | $\frac{6A%}{7}$ | B. | $\frac{1-A%}{7}$ | C. | $\frac{6(1-A%)}{7}$ | D. | (100-$\frac{7A}{6}$)% |
19.下列混合物,能用分液漏斗分离的是( )
| A. | 酒精和水 | B. | 食盐和水 | C. | 酱油和汽油 | D. | 芝麻和黄豆 |
16.1mol有机物甲,水解后得2molC2H6O和1molC2H2O4,该有机物是( )
| A. | CH3OOCCH2COOC2H5 | B. |  | ||
| C. | CH3COOCH2CH2COOCH3 | D. | CH3COOCH2COOC2H5 |
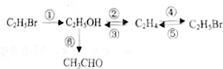
 ②CH3CH2OH
②CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O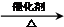 CH3CH2Br 乙醛的银镜反应
CH3CH2Br 乙醛的银镜反应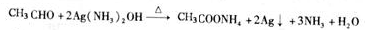
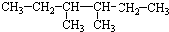 .
.