题目内容
20.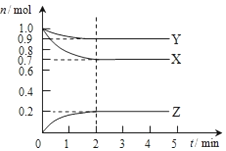 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:(1)该反应的化学方程式为:3X+Y?2Z;
(2)反应开始至2min,用X表示的平均反应速率为0.075mol•L-1•min-1 ;
(3)反应开始至2min时,Y的转化率为10%
(4)对于上述反应当改变下列条件时,反应速率会发生什么变化
(选填“增大”、“减小”或“不变”)?
①降低温度:减小
②保持容器的体积不变,增加X的物质的量:增大;
③保持容器的体积不变,增加He:不变;
④增大容器的体积:减小.
(5)下列叙述能说明上述反应一定达到化学平衡状态的是BE(填序号)
A.X、Y、Z的物质的量之比为3:1:2
B.X、Y、Z的浓度不再发生变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化
E.容器中的压强不再发生变化.
分析 (1)根据物质的量的变化判断反应物和生成物,根据物质的量的变化之比等于化学计量数之比书写方程式;
(2)分析图象计算X的消耗物质的量为1.0mol-0.7mol=0.3mol,结合反应速率概念计算,V=$\frac{△c}{△t}$;
(3)转化率=$\frac{消耗量}{起始量}$×100%;
(4)反应为气体体积减小的反应,结合一下反应速率的因素分析判断,增大压强、升高温度、增大浓度、加入催化剂等措施会提高反应速率;
(5)化学反应达到化学平衡状态时,正逆反应速率相等,且不等于0,各物质的浓度不再发生变化,由此衍生的一些物理量不发生变化,以此进行判断.
解答 解:(1)由图象可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为:3X+Y?2Z,
故答案为:3X+Y?2Z;
(2)分析图象计算X的消耗物质的量为1.0mol-0.7mol=0.3mol,从开始至2min,X的平均反应速率=$\frac{\frac{0.3mol}{2L}}{2min}$=0.075mol•L-1•min-1,
故答案为:0.075mol•L-1•min-1;
(3)反应开始至2min时,Y消耗物质的量1.0mol-0.9mol=0.1mol,Y的转化率=$\frac{0.1mol}{1.0mol}$×100%=10%,
(4)反应为气体体积减小的反应,
①减低温度反应速率减小,故答案为:减小;
②增加X的物质的量,增大浓度反应速率增大,故答案为:增大;
③保持容器的体积不变,增加He,总压增大,分压不变,平衡不变反应速率不变,故答案为:不变;
④增大容器的体积容器内压强减小,反应速率减小,故答案为:减小;
(5)A.X、Y、Z的物质的量之比为3:1:2为反应之比,不能说明反应正逆反应速率相同,故A错误;
B.X、Y、Z的浓度不再发生变化是平衡的标志,故B正确;
C.单位时间内每消耗3mol X,同时生成2mol Z,只能说明反应正向进行,不能说明反应达到平衡状态,故C错误;
D.混合气体的总质量始终不随时间的变化而变化,不能说明反应达到平衡状态,故D错误;
E.反应前后气体物质的量变化,容器中的压强不再发生变化.说明反应达到平衡状态,
故答案为:B、E;
点评 本题考查了化学反应速率、化学平衡的变化图象,化学平衡状态的判断,题目难度中等,注意化学方程式的确定方法以及反应速率计算,把握好相关概念和公式的理解及运用,主要是概念的计算应用,掌握基础是解题关键.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案| A. | k=2 | B. | k=$\frac{2}{3}$ | C. | 2≥k≥3 | D. | 2>k>$\frac{2}{3}$ |
| A. | 因为非金属性Cl强于S,所以向Na2SO3溶液中加盐酸,有气泡产生 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氨氟酸反应,所以是两性氧化物 |
| 分子式/结构式 | NO/N≡O | CO/C≡O | CO2/O=C=O | N2/N≡N |
| 化学键 | N≡O | C≡O | C=O | N≡N |
| 键能(KJ/mol) | 632 | 1072 | 750 | 946 |
| A. | Na | B. | SiO2 | C. | NaCl | D. | K2SO4 |
| A. | 电离产生阳离子全部是H+化合物叫酸,根据其分子中氢原子的个数确定该酸的元数 | |
| B. | 依据组成元素的种类,将纯净物分为单质和化合物 | |
| C. | 根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物和酸性氧化物 | |
| D. | 根据分散质微粒直径大小,将分散系分为胶体、浊液和溶液 |
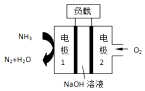
| A. | 电池总反应为:4NH3+3O2=2N2+6H2O | |
| B. | 电池工作时,OH-向正极移动 | |
| C. | 电极 2 发生的电极反应为:O2+4H++4e-=2H2O | |
| D. | 电流由电极 1 经外电路流向电极2 |
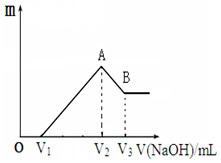 将镁、铝的混合物共0.1mol,溶于200mL 2.5mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题:
将镁、铝的混合物共0.1mol,溶于200mL 2.5mol•L-1的盐酸溶液中,然后再滴加2mol•L-1的NaOH溶液.请回答下列问题: