题目内容
8.下列说法正确的是( )| A. | 因为非金属性Cl强于S,所以向Na2SO3溶液中加盐酸,有气泡产生 | |
| B. | Fe(OH)3胶体无色、透明,能发生丁达尔现象 | |
| C. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| D. | SiO2既能和氢氧化钠溶液反应也能和氨氟酸反应,所以是两性氧化物 |
分析 A.最高价含氧酸酸性越强元素非金属性越强;
B.依据氢氧化铁胶体颜色解答;
C.H218O与D2O的摩尔质量均为20g/mol,且两者中均 含10个中子;
D.两性氧化物是指:既能与酸又能与碱反应,只生成盐和水的氧化物.
解答 解:A.因为非金属性Cl强于S,则HClO4酸性强于硫酸,不能得出盐酸酸性强于亚硫酸酸性的结论,故A错误;
B.Fe(OH)3胶体红褐色、透明,能发生丁达尔现象,故B错误;
C.H218O与D2O的摩尔质量均为20g/mol,故2.0gH218O与D2O的物质的量均为1mol,且两者中均 含10个中子,故1molH218O与D2O中均含10NA个中子,故C正确;
D.氢氟酸与二氧化硅反应生成四氟化硅和水,不符合两性氧化物的定义,不是两性氧化物,故D错误;
故选:C.
点评 本题为综合题,考查了元素非金属判断依据、胶体的性质、阿伏伽德罗常数应用、两性氧化物的概念,侧重考查学生对基础知识掌握熟练程度,题目难度不大.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案
相关题目
13.盐A与酸B反应,可放出气体C,C与NaOH反应生成A;C最终可氧化生成D;D溶于水生成B,则A、B分别是( )
| A. | Na2S和HCl | B. | Na2CO3和H2SO4 | C. | NaHCO3和HCl | D. | Na2SO3和 H2SO4 |
3.某离子反应涉及 H2O、ClO-、NH4+、H+、N2、Cl-六种微粒. 其中 c(NH4+)随反应进行逐渐减小.下列判断错误的是( )
| A. | 反应的氧化剂是 ClO- | |
| B. | 消耗 l mol 还原剂,转移电子 3 mol | |
| C. | 氧化剂与还原剂的物质的量之比为 2:3 | |
| D. | 反应后溶液的酸性明显增强 |
13.图中烧杯中盛的是天然水,铁腐蚀的速率由快到慢的顺序是( )


| A. | ⑤>②>①>③>④ | B. | ③>②>①>⑤>④ | C. | ⑤>②>③>④>① | D. | ③>④>⑤>②>① |
17.为达到表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法A.将气体通入盛有NaOH溶液的洗气瓶B.取样,滴加KSCN溶液C.取样,滴加酚酞试液D.取样,灼烧.
供选择的化学试剂及实验方法A.将气体通入盛有NaOH溶液的洗气瓶B.取样,滴加KSCN溶液C.取样,滴加酚酞试液D.取样,灼烧.
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
18.常温下,在溶液中能发生如下反应:①2A2++B2=2A3++2B-;②16H++10Z-+2XO4-?2X2++5Z2+8H2O③2B-+Z2=B2+2Z-,由此判断下列说法错误的是( )
| A. | Z2+2A2+=2A3++2Z-反应可以进行 | |
| B. | Z元素在②③反应中均被还原 | |
| C. | 氧化性由强到弱的顺序是XO4-、Z2、B2、A3+ | |
| D. | 还原性由强到弱顺序是A2+、B-、Z-、X2+ |
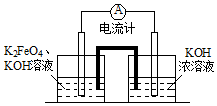 2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题:
2014年我国的冶金行业深受经济危机的冲击,尤其是Al、Fe的价格下滑幅度很大.请完成下面问题: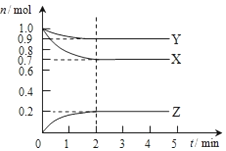 某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析:
某温度时,在2L容器中X、Y、Z三种气态物质的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析: