题目内容
9.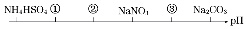 相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )
相同温度,相同浓度下的六种溶液,其pH由小到大的顺序如图所示,图中①②③代表的物质可能分別为( )| A. | NH4Cl、(NH4)2SO4、CH3COONa | B. | (NH4)2SO4、NH4Cl、CH3COONa | ||
| C. | (NH4)2SO4、NH4Cl、NaOH | D. | CH3COONa、NH4Cl、(NH4)2SO4 |
分析 NH4HSO4是强电解质,在溶液中完全电离,其溶液呈酸性,硝酸钠是强酸强碱盐,其溶液呈中性,碳酸钠是强碱弱酸盐,其溶液呈碱性,根据图知,①②溶液呈酸性,且①的酸性大于②,则如果都是酸时,①中酸的电离程度大于②,如果是酸和盐时,则①是强酸的酸式盐,②是盐,③溶液呈碱性,应该为盐溶液,且酸根离子的水解程度小于碳酸根离子.
解答 解:NH4HSO4是强电解质,在溶液中完全电离,其溶液呈酸性,硝酸钠是强酸强碱盐,其溶液呈中性,碳酸钠是强碱弱酸盐,其溶液呈碱性,根据图知,①②溶液呈酸性,且①的酸性大于②,则如果都是酸时,①中酸的电离程度大于②,如果是酸和盐时,则①是酸,②是盐,③溶液呈碱性,应该为盐溶液,且酸根离子的水解程度小于碳酸根离子.
A.NH4Cl中铵根离子的浓度小于(NH4)2SO4的,水解程度小,酸性弱,故A错误;
B.(NH4)2SO4中铵根离子的浓度小于NH4Cl的,水解程度大,酸性强,所以符合图象,故B正确;
C.氢氧化钠是强碱,其碱性强于碳酸钠溶液的,故C错误;
D.CH3COONa是强碱弱酸盐,水解显碱性;而(NH4)2SO4是强酸弱碱盐,其溶液呈酸性,故D错误;
故选B.
点评 本题考查了弱电解质的电离、盐类的水解等知识点,明确等浓度时,酸的强弱与溶液pH的关系、盐类水解程度与溶液pH的关系是解本题关键,难度中等.

练习册系列答案
相关题目
19.下列说法不正确的是( )
| A. | 硅胶作袋装食品的干燥剂没有发生化学变化 | |
| B. | 碳纤维是一种新开发的材料,它属于合成有机高分子化合物 | |
| C. | Al2O3用作耐火材料,Al(OH)3用作阻燃剂 | |
| D. | 小苏打是治疗胃酸过多的一种药剂 |
17.下列反应通过一步反应不能实现的是( )
| A. | CuO→Cu(OH)2 | B. | CaCO3→CaCl2 | C. | Na2SO4→NaCl | D. | Mg(NO3)2→KNO3 |
14.已知苯环上由于取代基的影响,使硝基邻位上的卤原子的反应活性增强,现有某有机物的结构简式如图:
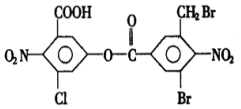
1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑醇羟基和硝基与氢氧化钠的反应,下同),溶液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为b,则a,b分别是( )
已知:RCH2COONa+NaOH(CaO)$\stackrel{△}{→}$RCH3+Na2CO3.

1mol该有机物与足量的氢氧化钠溶液混合并共热,充分反应后最多可消耗氢氧化钠的物质的量为a(不考虑醇羟基和硝基与氢氧化钠的反应,下同),溶液蒸干得到的固体产物再与足量的干燥碱石灰共热,又消耗氢氧化钠的物质的量为b,则a,b分别是( )
已知:RCH2COONa+NaOH(CaO)$\stackrel{△}{→}$RCH3+Na2CO3.
| A. | 5mol,10mol | B. | 6mol,2mol | C. | 8mol,4mol | D. | 8mol,2mol |
18.下列既是吸热反应,又是氧化还原反应的是( )
| A. | 碳在高温下和二氧化碳的反应 | B. | 碳不完全燃烧 | ||
| C. | 氯化铵与氢氧化钡晶体的反应 | D. | 铝和氧化铁在高温下的反应 |
