题目内容
云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注.利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理.
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O2-7,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程.

(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是: .
(2)在含Cr2O2-7废水中存在着平衡:Cr2
+H20?2Cr
+H+,请写出该平衡的平衡常数表达式k= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”).
(3)请写出通入SO2时发生的离子反应方程式: .
(4)写出加入铝粒在高温下发生反应制取铬的化学方程式 .
Ⅱ.还有一种净化处理方法是将含+6价Cr的废水放人电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O2-7发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KSPFe(OH)3=4.0×10-38,KSPCr(OH)3=6.0×10-31].
①电解过程中NaCI的作用是 .
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol?L-1,则溶液中c(Cr3+)为 mol?L-1.
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O2-7,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程.

(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是:
(2)在含Cr2O2-7废水中存在着平衡:Cr2
| O | 2- 7 |
| O | 2- 4 |
(3)请写出通入SO2时发生的离子反应方程式:
(4)写出加入铝粒在高温下发生反应制取铬的化学方程式
Ⅱ.还有一种净化处理方法是将含+6价Cr的废水放人电解槽内,用铁作阳极,加入适量的NaCl进行电解:阳极区生成的Fe2+和Cr2O2-7发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去[已知KSPFe(OH)3=4.0×10-38,KSPCr(OH)3=6.0×10-31].
①电解过程中NaCI的作用是
②已知电解后的溶液中c(Fe3+)为2.0×10-13mol?L-1,则溶液中c(Cr3+)为
考点:物质分离和提纯的方法和基本操作综合应用,化学平衡常数的含义,难溶电解质的溶解平衡及沉淀转化的本质
专题:实验设计题
分析:Ⅰ(1)在测定PH值时,不能湿润、稀释,需要用干燥结晶的玻璃棒;
(2)根据化学平衡常数的定义可解;加入水稀释,平衡向电离方向移动;
(3)二氧化硫与Cr2O72-离子发生氧化还原反应生成SO42-离子和Cr3+离子;
(4)根据铝热反应的概念进行解答;
Ⅱ①NaCl为电解质,加入适量的NaCl可增强溶液的导电能力;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+).
(2)根据化学平衡常数的定义可解;加入水稀释,平衡向电离方向移动;
(3)二氧化硫与Cr2O72-离子发生氧化还原反应生成SO42-离子和Cr3+离子;
(4)根据铝热反应的概念进行解答;
Ⅱ①NaCl为电解质,加入适量的NaCl可增强溶液的导电能力;
②先根据KspFe(OH)3和c(Fe3+)求出c(OH-),然后再根据c(OH-)和KspCr(OH)3求出c(Cr3+).
解答:
解:Ⅰ(1)在测定PH值时,不能湿润、稀释,正确的是将一小块PH试纸放在表面皿上,用玻璃棒蘸取少量待测液,滴在PH试纸上,静置几秒,再与比色卡对比;
故答案为:将一小块PH试纸放在表面皿上,用玻璃棒蘸取少量待测液,滴在PH试纸上,静置几秒,再与比色卡对比;
(2)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)的平衡常数K=
;
加入水稀释,平衡向电离方向移动,左边的离子稀释为1,右边的离子系数为3,加水平衡正向移动;
故答案为:
;正;
(3)重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,
故答案为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
(4)根据铝热反应的概念,铝与氧化铬在高温下生成铬和氧化铝,反应方程式为2Al+Cr2O3
Al2O3+2Cr;
故答案为:2Al+Cr2O3
Al2O3+2Cr;
Ⅱ①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强溶液的导电性;
②溶液中c(OH-)=
=
mol/L=
mol/L,则溶液中c(Cr3+)=
=
=3.0×10ˉ6mol/L,
故答案为:3.0×10ˉ6.
故答案为:将一小块PH试纸放在表面皿上,用玻璃棒蘸取少量待测液,滴在PH试纸上,静置几秒,再与比色卡对比;
(2)根据化学平衡常数的定义,可知Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)的平衡常数K=
c2(C
| ||
c(
|
加入水稀释,平衡向电离方向移动,左边的离子稀释为1,右边的离子系数为3,加水平衡正向移动;
故答案为:
c2(C
| ||
c(
|
(3)重铬酸根具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,
故答案为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
(4)根据铝热反应的概念,铝与氧化铬在高温下生成铬和氧化铝,反应方程式为2Al+Cr2O3
| ||
故答案为:2Al+Cr2O3
| ||
Ⅱ①因NaCl为电解质,加入适量的NaCl可增强溶液的导电能力,故答案为:增强溶液的导电性;
②溶液中c(OH-)=
| 3 |
| ||
| 3 |
| ||
| 3 | 2.0×10-25 |
| KspCr(OH)3 |
| C3(OH-) |
| 6.0×10-31 |
| 2.0×10-25 |
故答案为:3.0×10ˉ6.
点评:本题考查了PH值测定、化学平衡常数的计算以及Ksp的有关计算等内容,题目难度中等,注意对图象的分析和数据的处理.

练习册系列答案
相关题目
草药莪术根茎中含有一种色素,它的结构如图,用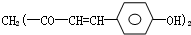 它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
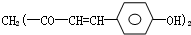 它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )
它制成的试纸可以检验酸碱性,能够跟1mol该化合物起反应的NaOH和H2的最大量分别为( )| A、3mol,3mol |
| B、1mol,5mol |
| C、6mol,8mol |
| D、2mol,10mol |
100mL 2mol/L的硫酸和过量的锌反应,为加快反应速率,但又不影响生成氢气的总量,可采取的措施是( )
| A、升高温度 |
| B、改用含有少量杂质铜的锌 |
| C、改用98%的浓硫酸 |
| D、加水 |
化学与生活、社会密切相关.下列说法正确的是( )
| A、石油的分馏、煤的气化、海水提溴过程都包含化学变化 |
| B、地沟油经处理后可作为汽车燃油,故地沟油成分是液态烃 |
| C、淀粉、油脂、蛋白质都能水解,但水解产物不同 |
| D、乙烯和苯都能使溴水褪色,且褪色的原因相同 |
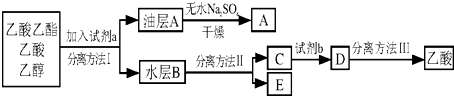
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、通入足量CO2后的溶液中:Na+、SiO32-、C6H5O-、CH3COO- | ||
B、
| ||
| C、pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | ||
| D、c(ClO-)=1.0 mol?L-1的溶液:Na+、SO32-、S2-、SO42- |
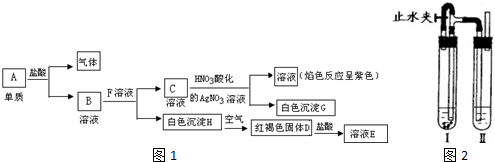
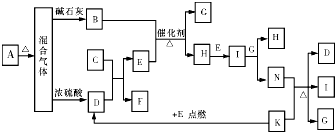 如图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物.固态物质A(混合物)加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D.各物质间的转化关系如图所示.请回答下列问题:
如图中的B~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体;E是常见的气体单质,I是红棕色的气态氧化物.固态物质A(混合物)加热后生成的气体混合物若通过碱石灰只剩余气体B,若通过浓硫酸则只剩余气体D.各物质间的转化关系如图所示.请回答下列问题: