题目内容
(1)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述关系一定不正确的是 (填序号).
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为 (填序号).
③若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显 (填“酸性”、“碱性”或“中性”).
(2)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种.已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同.则:B是 溶液,C是 .
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
①上述关系一定不正确的是
②若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为
③若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显
(2)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种.已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同.则:B是
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:(1)①任何电解质溶液中都存在电荷守恒,根据电荷守恒判断;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),但水解程度很小;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒判断c(H+)、c(OH-)相对大小;
(2)A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7,以此解答该题.
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),但水解程度很小;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒判断c(H+)、c(OH-)相对大小;
(2)A、C溶液的pH相同,A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,A、B为CH3COONa溶液、NH4Cl溶液.故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,溶液的pH=7,以此解答该题.
解答:
解:(1)①任何电解质溶液中都存在电荷守恒,如果c(OH-)>c(H+),根据电荷守恒得c(Cl-)<c(NH4+),故B错误,
故答案为:B;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),但水解程度很小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:A;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒得c(H+)=c(OH-),溶液呈中性,故答案为:中性;
(2)CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3四种溶液,CH3COONa为强碱弱酸盐,水解成碱性,促进水的电离;NH4Cl溶液为强酸弱碱盐,水解成酸性,促进水的电离;盐酸溶液呈酸性,抑制水的电离,NaNO3为强酸强碱盐,溶液呈中性,A、C溶液的pH相同,则A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,则A、B为CH3COONa溶液、NH4Cl溶液,故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,
故答案为:CH3COONa;盐酸.
故答案为:B;
②若溶液中只有一种溶质,为NH4Cl,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(Cl-)>c(NH4+),但水解程度很小,所以离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故答案为:A;
③若四种离子浓度关系有c(NH4+)=c(Cl-),根据电荷守恒得c(H+)=c(OH-),溶液呈中性,故答案为:中性;
(2)CH3COONa溶液、NH4Cl溶液,盐酸和NaNO3四种溶液,CH3COONa为强碱弱酸盐,水解成碱性,促进水的电离;NH4Cl溶液为强酸弱碱盐,水解成酸性,促进水的电离;盐酸溶液呈酸性,抑制水的电离,NaNO3为强酸强碱盐,溶液呈中性,A、C溶液的pH相同,则A、C为NH4Cl溶液、盐酸;A、B溶液中水的电离程度相同,则A、B为CH3COONa溶液、NH4Cl溶液,故A为NH4Cl溶液,B为CH3COONa溶液,C为盐酸,D为NaNO3溶液,
故答案为:CH3COONa;盐酸.
点评:本题考查离子浓度大小比较,明确溶液中的溶质及其性质是解本题关键,根据溶液酸碱性确定其它离子浓度相对大小,侧重考查学生分析问题、解答问题能力,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
短周期元素X、Y的原子序数相差2,下列有关叙述正确的是( )
| A、X与Y不可能位于同一主族 |
| B、X与Y一定位于同一周期 |
| C、X与Y可能形成共价化合物XY |
| D、X与Y可能形成离子化合物XY |
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
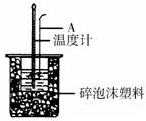

| A、稍过量的氢氧化钠是确保盐酸完全反应 |
| B、仪器A的名称是环形玻璃搅拌棒 |
| C、在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H偏大 |
| D、用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
下列有关物质性质及应用的说法正确的是( )
| A、过量的铜与浓硝酸反应可生成NO |
| B、Fe在O2中的燃烧产物可用于制红色涂料 |
| C、Na、Cu可以分别用电解冶炼法、热还原法得到 |
| D、Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
下列说法错误的是( )
| A、由电能转化为化学能的装置叫电解池 |
| B、在电解池中跟直流电源的正极相连的电极是电解池的阳极 |
| C、在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极 |
| D、电解池中阴极发生还原反应,阳极发生氧化反应 |
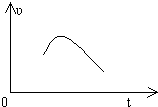 把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )