题目内容
下表是短周期中部分元素的原子半径及主要化合价.
请回答:
(1)X在元素周期表中的位置是
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是 (用离子符号表示).用离子方程式表示出Z离子可作净水剂的原因:
(3)上述某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式. .
| 元素代号 | U | V | W | X | Y | Z |
| 原子半径/nm | 0.037 | 0.157 | 0.066 | 0.070 | 0.077 | 0.143 |
| 主要化合价 | +1 | +1 | -2 | -3 +5 | +2 +4 | +3 |
(1)X在元素周期表中的位置是
(2)V、W、Z三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是
(3)上述某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式.
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:主族元素中,元素最高化合价与其族序数相等,最大化合价=族序数-8,同一主族元素中,原子半径随着原子序数增大而增大,同一周期元素中,原子半径随着原子序数增大而减小,
根据表中化合价知,U、V为第IA族元素,W属于第VIA族元素,X属于第VA族元素,Y属于第IV族元素,Z属于第IIIA族元素,U原子半径最小则U为H元素,X原子半径和Y相近且X原子半径小于Y且都小于V,则Y为C、X为N元素、V为Na元素;
Z原子半径和V相近,则Z为Al元素;
W原子半径小于X,则W为O元素;
再结合原子结构、物质结构分析解答.
根据表中化合价知,U、V为第IA族元素,W属于第VIA族元素,X属于第VA族元素,Y属于第IV族元素,Z属于第IIIA族元素,U原子半径最小则U为H元素,X原子半径和Y相近且X原子半径小于Y且都小于V,则Y为C、X为N元素、V为Na元素;
Z原子半径和V相近,则Z为Al元素;
W原子半径小于X,则W为O元素;
再结合原子结构、物质结构分析解答.
解答:
解:主族元素中,元素最高化合价与其族序数相等,最大化合价=族序数-8,同一主族元素中,原子半径随着原子序数增大而增大,同一周期元素中,原子半径随着原子序数增大而减小,
根据表中化合价知,U、V为第IA族元素,W属于第VIA族元素,X属于第VA族元素,Y属于第IV族元素,Z属于第IIIA族元素,U原子半径最小则U为H元素,X原子半径和Y相近且X原子半径小于Y且都小于V,则Y为C、X为N元素、V为Na元素;
Z原子半径和V相近,则Z为Al元素;
W原子半径小于X,则W为O元素;
(1)X为N元素,N原子核外有2个电子、最外层电子数为5,所以N元素在元素周期表中的位置是第二周期第VA族,故答案为:第二周期第VA族;
(2)V是Na元素、W是O元素、Z为Al元素,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以Na、O、Al三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是O2->Na+>Al3+,铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中悬浮物而净水,离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,故答案为:O2->Na+>Al3+;Al3++3H2O?Al(OH)3(胶体)+3H+;
(3)上述某些元素可形成既含离子键又含共价键的化合物如NaOH,NaOH电子式为 ,故答案为:
,故答案为: .
.
根据表中化合价知,U、V为第IA族元素,W属于第VIA族元素,X属于第VA族元素,Y属于第IV族元素,Z属于第IIIA族元素,U原子半径最小则U为H元素,X原子半径和Y相近且X原子半径小于Y且都小于V,则Y为C、X为N元素、V为Na元素;
Z原子半径和V相近,则Z为Al元素;
W原子半径小于X,则W为O元素;
(1)X为N元素,N原子核外有2个电子、最外层电子数为5,所以N元素在元素周期表中的位置是第二周期第VA族,故答案为:第二周期第VA族;
(2)V是Na元素、W是O元素、Z为Al元素,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以Na、O、Al三种元素的离子具有相同的电子层结构,三者的离子半径由大到小顺序是O2->Na+>Al3+,铝离子水解生成氢氧化铝胶体,胶体具有吸附性,能吸附水中悬浮物而净水,离子方程式为Al3++3H2O?Al(OH)3(胶体)+3H+,故答案为:O2->Na+>Al3+;Al3++3H2O?Al(OH)3(胶体)+3H+;
(3)上述某些元素可形成既含离子键又含共价键的化合物如NaOH,NaOH电子式为
 ,故答案为:
,故答案为: .
.
点评:本题考查位置结构性质的相互关系及应用,涉及离子半径大小比较、盐类水解、电子式的书写等知识点,明确物质的结构、性质即可解答,熟练掌握原子结构、元素周期律等知识点并灵活运用,题目难度不大.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
短周期元素X、Y、Z在元素周期表中的位置如图所示,下列说法正确的是( )


| A、X、Y、Z三种元素中,X的非金属性最强 |
| B、Y的氢化物的稳定性比Z的强 |
| C、Y的最高正化合价为+7价 |
| D、X的单质的熔点比Z的高 |
短周期金属元素甲~戊在周期表中的相对位置如下表所示,下面判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:丙<丁<戊 |
| B、金属性:甲<丙 |
| C、氢氧化物碱性:丙>丁>戊 |
| D、最外层电子数:甲>乙 |
X、Y、Z为三种短周期元素,X、Y处在相邻的两个周期,X原子的最外层电子数是Y原子最外层电子数的2倍,Y的原子序数比X的原子序数多5,Z原子与Y原子的最外层电子数之差为3.下列叙述正确的是( )
| A、X、Y、Z三种元素不能组成一种盐 |
| B、X单质与Z单质直接反应可生成两种化合物 |
| C、X、Y、Z的最高价氧化物对应的水化物,可能是酸、碱或两性的物质 |
| D、X、Y形成的一种离子跟H+反应可生成Y的离子 |
短周期元素X、Y的原子序数相差2,下列有关叙述正确的是( )
| A、X与Y不可能位于同一主族 |
| B、X与Y一定位于同一周期 |
| C、X与Y可能形成共价化合物XY |
| D、X与Y可能形成离子化合物XY |
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
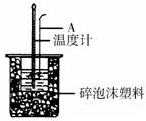

| A、稍过量的氢氧化钠是确保盐酸完全反应 |
| B、仪器A的名称是环形玻璃搅拌棒 |
| C、在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H偏大 |
| D、用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
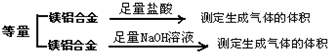
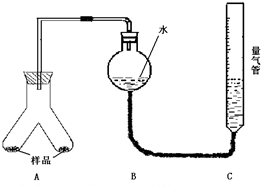 为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题:
为测定镁铝合金(不含其它元素)中铝的质量分数,甲乙两个学习小组设计了下列二种不同的实验方案进行探究.请回答下列问题: