题目内容
标准状况下,22.4LHCl气体溶于水,配制成250mL盐酸,求:
(1)所得溶液中氯化氢的物质的量浓度?
(2)若将该盐酸稀释成1L溶液,求稀释后盐酸的物质的量浓度?
(3)若将(2)的溶液取出250mL与足量的锌粒反应可以产生多少体积的氢气?(标准状况下)
(1)所得溶液中氯化氢的物质的量浓度?
(2)若将该盐酸稀释成1L溶液,求稀释后盐酸的物质的量浓度?
(3)若将(2)的溶液取出250mL与足量的锌粒反应可以产生多少体积的氢气?(标准状况下)
考点:物质的量浓度的相关计算,化学方程式的有关计算
专题:计算题
分析:(1)根据n=
计算标况下22.4LHCl的物质的量,再根据c=
计算所得溶液的物质的量浓度;
(2)根据稀释定律,稀释前后HCl的物质的量不变,再根据c=
计算稀释后溶液的物质的量浓度;
(3)发生反应Zn+2HCl=ZnCl2+H2↑,根据n=cV计算250mL溶液中n(HCl),再根据方程式计算生成氢气的体积.
| V |
| Vm |
| n |
| v |
(2)根据稀释定律,稀释前后HCl的物质的量不变,再根据c=
| n |
| v |
(3)发生反应Zn+2HCl=ZnCl2+H2↑,根据n=cV计算250mL溶液中n(HCl),再根据方程式计算生成氢气的体积.
解答:
解:(1)标况下22.4LHCl的物质的量n=
=
=1mol,配成250mL溶液,所得溶液的物质的量浓度c=
=
=4mol/L,故答案为:4mol/L;
(2)根据稀释定律,稀释前后HCl的物质的量不变,稀释1L后所得盐酸溶液的物质的量浓度c=
=
=1mol/L,故答案为:1mol/L;
(3)取稀释后的盐酸250mL,则250mL溶液中n(HCl)=1mol/L×0.25L=0.25mol,令反应生成标况下氢气的体积为V,则:
Zn+2HCl=ZnCl2+H2↑,
1mol 22.4L
0.25mol V
所以,2mol:0.25mol=22.4L:V,解得V=2.8L,
答:标准状况下可以生成2.8L氢气.
| V |
| Vm |
| 22.4L |
| 22.4L/mol |
| n |
| v |
| 1mol |
| 0.25mL |
(2)根据稀释定律,稀释前后HCl的物质的量不变,稀释1L后所得盐酸溶液的物质的量浓度c=
| n |
| v |
| 1mol |
| 1L |
(3)取稀释后的盐酸250mL,则250mL溶液中n(HCl)=1mol/L×0.25L=0.25mol,令反应生成标况下氢气的体积为V,则:
Zn+2HCl=ZnCl2+H2↑,
1mol 22.4L
0.25mol V
所以,2mol:0.25mol=22.4L:V,解得V=2.8L,
答:标准状况下可以生成2.8L氢气.
点评:本题考查物质的量浓度计算、根据方程式的计算,比较基础,注意理解物质的量浓度定义,侧重对基础知识的巩固,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
短周期金属元素甲~戊在周期表中的相对位置如下表所示,下面判断不正确的是( )
| 甲 | 乙 | |
| 丙 | 丁 | 戊 |
| A、原子半径:丙<丁<戊 |
| B、金属性:甲<丙 |
| C、氢氧化物碱性:丙>丁>戊 |
| D、最外层电子数:甲>乙 |
下列溶液中,由水电离出的c(H+)<10-7mol?L-1的是( )
| A、25℃时,0.01mol?L-1NH4Cl溶液 |
| B、25℃时,0.01mol?L-1NaHSO4溶液 |
| C、100℃时,0.01mol?L-1NaNO3溶液 |
| D、25℃时,0.01mol?L-1NaF溶液 |
下列电离方程式中,正确的是( )
| A、Al2(SO4)3═2Al3++3SO42- |
| B、NaHCO3═Na++H++CO32- |
| C、CH3COOH═CH3COO-+H+ |
| D、Na2CO3═Na2++CO32- |
分别取40mL的0.50mol/L盐酸与40mL0.55mol/L氢氧化钠溶液进行中和热的测定.下列说法错误的是( )
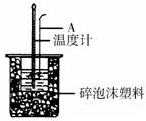

| A、稍过量的氢氧化钠是确保盐酸完全反应 |
| B、仪器A的名称是环形玻璃搅拌棒 |
| C、在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H偏大 |
| D、用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,结果也是正确的 |
四个试管中都装有5mL 0.1mol?L-1 Na2S2O3溶液,分别在不同温度下加入硫酸和一定量水,最先出现浑浊的是( )
| A、20℃,10 mL 0.1mol?L-1硫酸 |
| B、20℃,5 mL 0.1 mol?L-1硫酸和5 mL水 |
| C、30℃,10 mL 1 mol?L-1硫酸 |
| D、30℃,5 mL 1 mol?L-1硫酸和5 mL水 |
下列有关物质性质及应用的说法正确的是( )
| A、过量的铜与浓硝酸反应可生成NO |
| B、Fe在O2中的燃烧产物可用于制红色涂料 |
| C、Na、Cu可以分别用电解冶炼法、热还原法得到 |
| D、Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性 |
哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1mol N2和3mol H2,在一定条件下使该反应发生:N2+3H2
2NH3,下列有关说法正确的是( )
| 高温、高压 |
| 催化剂 |
| A、达到化学平衡时,N2将完全转化为NH3 |
| B、达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 |
| C、达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 |
| D、达到化学平衡时,正反应和逆反应的速率都为零 |