题目内容
2.过氧乙酸是一种弱酸性氧化剂,极不稳定,广泛用作漂白剂和高效杀菌消毒剂等.Ⅰ、制备:冰醋酸与H2O2浓溶液按体积比1:1混合,加入适量浓硫酸,控制温度5℃~30℃,搅拌30min并静置4~6h.反应原理为:H2O2+CH3COOH$\stackrel{浓H_{2}SO_{4}}{→}$
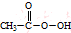 (过氧乙酸)+H2O
(过氧乙酸)+H2OⅡ、含量测定:称取5.0000g过氧乙酸试样(液体),稀释至100mL备用.取上述稀释后过氧乙酸试样5.00mL,用0.0100mol•L-1KMnO4溶液滴定到终点以除去其中的H2O2,随即加入10%KI溶液10mL(足量),加入0.5%淀粉溶液3滴,摇匀,并用0.0500mol•L-1Na2S2O3标准溶液滴定到终点(离子反应方程式为:I2+2S2O32-═2I-+S4O62-),消耗Na2S2O3标准溶液的总体积为20.00mL.
(1)制备过氧乙酸时,温度不宜过高,其原因可能是温度过高H2O2和CH3COOOH会分解.
(2)稀释样品时,除用到烧杯及玻璃棒外,还用到的玻璃仪器有100mL容量瓶、胶头滴管.
(3)用Na2S2O3标准溶液滴定到终点的现象是溶液蓝色刚好褪去,且半分钟不变化.
(4)通过计算确定原试样中过氧乙酸的质量分数(写出计算过程).
分析 (1)温度过高时过氧化氢会分解不能保证其和醋酸充分反应,同时过氧乙酸也容易分解;
(2)称取5.0000g过氧乙酸试样(液体),稀释至100mL时,除用到烧杯及玻璃棒外,还要用到胶头滴管取液体,要用100mL容量瓶定容;
(3)用Na2S2O3标准溶液滴定到终点时,溶液中的碘全部参加反应,溶液的蓝色会褪色,据此答题;
(4)根据(3)的方程式及I2+2S2O32-=2I-+S4O62-两个化学方程式,可以得关系式如下:CH3COOOH~I2~2Na2S2O3,据此计算稀释后5mL反应中n(CH3COOOH),进而计算原试样中过氧乙酸的质量分数.
解答 解:(1)温度过高时过氧化氢会分解不能保证其和醋酸充分反应,同时过氧乙酸也容易分解,
故答案为:温度过高H2O2和CH3COOOH会分解;
(2)称取5.0000g过氧乙酸试样(液体),稀释至100mL时,除用到烧杯及玻璃棒外,还要用到胶头滴管取液体,要用100mL容量瓶定容,
故答案为:100mL容量瓶、胶头滴管;
(3)用Na2S2O3标准溶液滴定到终点时,溶液中的碘全部参加反应,溶液的蓝色会褪色,所以滴定到终点的现象是溶液蓝色刚好褪去,且半分钟不变化,
故答案为:溶液蓝色刚好褪去,且半分钟不变化;
(4)根据(3)的方程式及I2+2S2O32-=2I-+S4O62-两个化学方程式,可以得关系式如下:CH3COOOH~I2~2Na2S2O3,由关系式可知,n(CH3COOOH)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×0.05mol/L×0.02L=5×10-4mol,故原样品中w(CH3COOOH)=$\frac{5×10{\;}^{-4}mol×76g/mol}{5g×\frac{5mL}{100mL}}$×100%=15.2%,
答:原试样中过氧乙酸的质量分数为15.2%.
点评 本题考查氧化还原反应滴定、实验原理的分析和多步反应关系的计算等,难度中等,(4)中注意利用关系式进行计算,为易错点,学生容易忽略滴定中所取溶液的体积,按稀释后溶液体积计算,导致错误答案.

| A. | 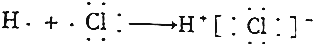 | |
| B. | 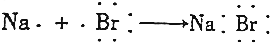 | |
| C. | 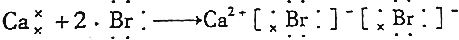 | |
| D. | 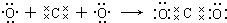 |
| A. | 金属元素在不同的化合物中化合价均相同 | |
| B. | 所有合金都只含有金属元素 | |
| C. | 可利用铝热反应冶炼单质镁 | |
| D. | 镁合金的硬度和强度均高于纯镁 |
| A. | 目前我国流通的硬币是由合金材料制造的 | |
| B. | 生铁、普通钢和不锈钢中的碳含量依次增加 | |
| C. | 装修门窗使用的铝合金材料的硬度比铝大,熔点比铝低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
| A. | 推广“低碳经济”,减少温室气体的排放 | |
| B. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 采用“绿色化学”工艺,使原料尽可能转化为所需要的物质 | |
| D. | 关停化工企业,消除污染源头 |
| A. | 此白色固体不可能是KHCO3和KOH的混合物 | |
| B. | 此白色固体中含有K2CO36.90g | |
| C. | 原KOH溶液的物质的量浓度是0.500 mol•L-1 | |
| D. | 此白色固体可能为KOH和K2CO3的混合物 |
 立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.
立方氮化硼是一种超硬材料,可由:2Mg3B2N4+3O2 $\frac{\underline{\;\;\;\;\;高温,加热\;\;\;\;\;}}{添加剂,催化剂}$6MgO+4BN+2N2制备.
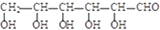 碱性条件下氧化为
碱性条件下氧化为 .
.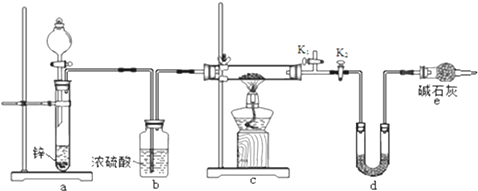
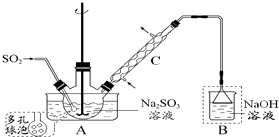 次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得:
次硫酸氢钠甲醛(NaHSO2•HCHO•2H2O) 俗称吊块,在印染、医药以及原子能工业中应用广泛.实验室以Na2SO3、SO2、HCHO和锌粉为原料,通过以下反应制得: