题目内容
有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )
| A、氨水的电离作用大于氯化铵的水解作用 |
| B、氯化铵的水解作用大于氨水的电离作用 |
| C、氨水的存在抑制了氯化铵的水解 |
| D、氯化铵的存在抑制了氨水的电离 |
考点:弱电解质在水溶液中的电离平衡,盐类水解的原理
专题:
分析:pH为9.3,说明溶液呈碱性,氨水的电离作用大于氯化铵的水解作用,据此解题.
解答:
解:A.溶液呈碱性,氨水的电离作用大于氯化铵的水解作用,故A正确;
B.溶液呈碱性氯化铵的水解作用大于氨水的电离作用,故B错误;
C.氯化铵水解生成一水合氨,氨水的存在抑制了氯化铵的水解,故C正确;
D.氨水电离生成铵根,氯化铵的存在抑制了氨水的电离,故D正确.
故选B.
B.溶液呈碱性氯化铵的水解作用大于氨水的电离作用,故B错误;
C.氯化铵水解生成一水合氨,氨水的存在抑制了氯化铵的水解,故C正确;
D.氨水电离生成铵根,氯化铵的存在抑制了氨水的电离,故D正确.
故选B.
点评:本题考查弱电解质在水溶液中的电离平衡,题目难度中等,注意掌握溶液酸碱性的判断方法.

练习册系列答案
相关题目
下列图示与对应叙述相符合的是( )
A、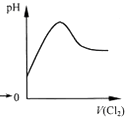 表示Cl2通入SO2溶液中pH的变化 |
B、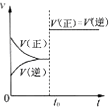 表示已达平衡的某可逆反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
C、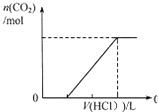 表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
D、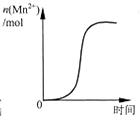 表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
下列溶液中微粒的物质的量浓度关系正确的是( )
| A、1L 0.1mol/L(NH4)2Fe(SO4)2的溶液:c(SO42-)>c(NH4+)>c(Fe2+)>c(OH-)>c(H+) |
| B、在Na2CO3和NaHCO3的混合溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| C、常温下,CH3COONa溶液和盐酸混合所得中性溶液:c(Na+)>c(Cl-)=c(CH3COOH) |
| D、25℃时,pH=4.5的NaHC2O4溶液:c(HC2O4-)>c(C2O42-)>c(H2C2O4) |
一定温度下,用水稀释0.1mol?L-1的一元弱酸HA,随着水量的增加,下列数值一定增大的是( )
| A、Kw |
| B、c(H+)/Ka |
| C、c(HA)/c(A-) |
| D、c(OH-) |
根据图,下列判断中正确的是( )


| A、烧杯a中的溶液pH降低 |
| B、烧杯b中发生氧化反应 |
| C、烧杯a中发生的反应为2H++2e-═H2 |
| D、烧杯b中发生的反应为2Cl--2e-═Cl2 |

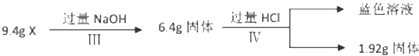
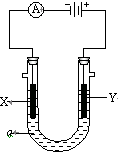 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: