题目内容
下列图示与对应叙述相符合的是( )
A、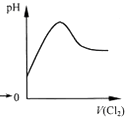 表示Cl2通入SO2溶液中pH的变化 |
B、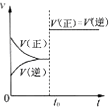 表示已达平衡的某可逆反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
C、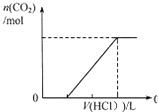 表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
D、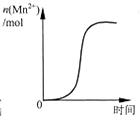 表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
考点:氯气的化学性质,离子方程式的有关计算,物质的量或浓度随时间的变化曲线,浓度、温度、催化剂对化学反应速率的影响
专题:
分析:A.Cl2通入SO2溶液中生成盐酸和硫酸,溶液pH减小;
B.如反应前后气体的计量数之和相等,则也可为增大压强;
C.生成气体前后消耗的盐酸的比值为2:1;
D.高锰酸钾被还原生成Mn2+,为反应的催化剂,可增大反应速率.
B.如反应前后气体的计量数之和相等,则也可为增大压强;
C.生成气体前后消耗的盐酸的比值为2:1;
D.高锰酸钾被还原生成Mn2+,为反应的催化剂,可增大反应速率.
解答:
解:A.发生Cl2+SO2+2H2O=H2SO4+2HCl,溶液酸性增强,pH减小,故A错误;
B.如反应前后气体的计量数之和相等,增大压强,平衡不移动,则也可为增大压强,故B错误;
C.先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体,且等物质的量NaOH、Na2CO3,不产生气体和产生气体消耗的酸应为2:1,与图象不符,故C错误;
D.高锰酸钾被还原生成Mn2+,为反应的催化剂,可增大反应速率,故D正确.
故选D.
B.如反应前后气体的计量数之和相等,增大压强,平衡不移动,则也可为增大压强,故B错误;
C.先发生NaOH与HCl反应,再发生碳酸钠与盐酸反应生成碳酸氢钠,最后发生碳酸氢钠与盐酸的反应生成气体,且等物质的量NaOH、Na2CO3,不产生气体和产生气体消耗的酸应为2:1,与图象不符,故C错误;
D.高锰酸钾被还原生成Mn2+,为反应的催化剂,可增大反应速率,故D正确.
故选D.
点评:本题考查了图象分析,明确物质的性质及物质反应先后顺序是解本题关键,注意C选项碳酸钠和盐酸分两步反应,为易错点.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
下列实验方案合理的是( )
| A、向水中滴加FeCl3的稀溶液,以制备Fe(OH)3胶体 |
| B、用盐酸滴定氢氧化钠,用酚酞作指示剂,当锥形瓶中溶液由无色变成红色时即达到滴定终点 |
| C、室温下,用pH试纸测定浓度为0.1 mol?L-1 NaClO溶液和0.1 mol?L-1 CH3COONa溶液的pH,比较HClO和CH3COOH的酸性强弱 |
| D、室温下,向Mg(OH)2中加入饱和氯化铵溶液能使Mg(OH)2溶解 |
有8种物质:①甲烷、②苯、③聚乙烯、④1,3-丁二烯、⑤2-丁炔、⑥己烷、⑦裂解气.其中能使酸性高锰酸钾溶液褪色的是( )
| A、①②③ | B、②⑥⑦ |
| C、③④⑤ | D、④⑤⑦ |
等质量的下列有机物完全燃烧,消耗O2最多的是( )
| A、CH4 |
| B、CH3CH3 |
| C、C2H2 |
| D、C3H8 |
有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )
| A、氨水的电离作用大于氯化铵的水解作用 |
| B、氯化铵的水解作用大于氨水的电离作用 |
| C、氨水的存在抑制了氯化铵的水解 |
| D、氯化铵的存在抑制了氨水的电离 |
1g氢气在氧气中完全燃烧生成液态水,放出142.9kJ热量,表示该反应的热化学方程式的是( )
A、H2(g)+
| ||
B、H2(g)+
| ||
| C、2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ/mol | ||
D、H2+
|