题目内容
14.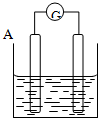 按要求回答下列问题:
按要求回答下列问题:(1)若电流表的指针偏向B,则A为正极,B为负极
(2)若电流表G发生偏转,同时A极质量增加,B极质量减少,C为电解质溶液.则A、B、C分别为D
A、A是Zn,B是Cu,C是稀硫酸
B、A是Cu,B是Zn,C是稀硫酸
C、A是Fe,B是Ag,C是稀AgNO3溶液
D、A是Ag,B是Fe,C是稀AgNO3溶液
(3)若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,则A、B的金属性强弱为A>B
(4)任何一个自发的氧化还原反应都可以设计为原电池,若该电池中发生的反应为:Fe+2FeCl3═3FeCl2,A电极为铁,则B电极为铜或碳棒.
分析 (1)电流表的指针由正极偏向负极,偏向B极,则B为负极,A为正极;
(2)原电池中负极的活泼性大于正极的活泼性,负极上金属失电子变成离子进入溶液,质量减少,正极上得电子发生还原反应,正极上析出物质,若析出的物质是金属,则正极质量增加;
(3)若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,溶解的一极为负极,产生气泡的为正极,负极活泼;
(4)若该电池中发生的反应为:Fe+2FeCl3═3FeCl2,A电极为铁,A为负极,则B电极选择比A不活泼的金属或非金属导体.
解答 解:(1)电流表的指针由正极偏向负极,偏向B极,则B为负极,A为正极,故答案为:正;负;
(2)该原电池中,A极逐渐增加,B极逐渐减少,所以B作负极,A作正极,B的活泼性大于A的活泼性,所以排除AC选项;
A极逐渐增加,说明有金属析出,B选项析出氢气不是金属,D选项析出金属,所以D符合题意.
故选D;
(3)若电解质溶液是稀硫酸,按此图组装后,观察到A极不断的溶解,B极有气泡冒出,溶解的一极为负极,产生气泡的为正极,负极活泼,故答案为:A>B;
(4)若该电池中发生的反应为:Fe+2FeCl3═3FeCl2,A电极为铁,A为负极,则B电极选择比A不活泼的金属或非金属导体,故A电极为铜或碳棒,故答案为:铜或碳棒.
点评 本题考查原电池知识,侧重于学生的分析能力的考查,注意把握原电池的工作原理,学习中注意相关基础知识的积累,难度不大.

练习册系列答案
 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
1.等物质的量的下列有机物完全燃烧,消耗氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C2H2 | D. | C5H12 |
5.可以用来鉴别甲烷和乙烯,还可以用来除去甲烷中乙烯的操作方法是( )
| A. | 澄清石灰水、浓硫酸 | B. | KMnO4酸性溶液、浓硫酸 | ||
| C. | 溴水、浓硫酸 | D. | 浓硫酸、KMnO4酸性溶液 |
2.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④结合质子能力:OH->CH3COO->Cl-.
①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④结合质子能力:OH->CH3COO->Cl-.
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
9.除去蛋白质溶液中混入的少量氯化钠,采用的方法是( )
| A. | 过滤 | B. | 电泳 | C. | 渗析 | D. | 分液 |
19.放射性同位素${\;}_{92}^{238}$U的原子核内的中子数和核外电子数之差是( )
| A. | 54 | B. | 92 | C. | 146 | D. | 238 |
6.下列关于充电电池的叙述,不正确的是( )
| A. | 充电电池可以通过放电、充电实现化学能和电能的相互转化 | |
| B. | 放电时负极发生氧化反应,充电时该电极上有物质发生得电子的反应 | |
| C. | 现代技术使得电池设计比较先进,电池废弃后不必再进行无毒化处理 | |
| D. | 充电电池的化学反应原理是氧化还原反应 |
3.甲、乙、丙、丁是原子序数依次增大的四种短周期元素,A、B、C、D、E是由其中的两种或三种元素组成的化合物,F是由丙元素形成的单质.已知:A+B=D+F,A+C=E+F;D是强碱,下列说法正确的是( )
| A. | 原子半径:丁>丙>乙>甲 | |
| B. | 1mol A与足量B完全反应共转移了2mol电子 | |
| C. | 丙元素在周期表中的位置为第二周期第ⅣA族 | |
| D. | 甲、乙、丙、丁四种元素可以共同组成多种盐 |
 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题: