题目内容
4. 铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:
铁和铜都是日常生活中常见的金属,有着广泛的用途.请回答下列问题:(1)Fe3+的外围电子排布式为3d5.
(2)配合物Fe(CO)x 常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x 晶体属于分子晶体(填晶体类型).
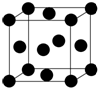
(3)Cu的晶胞如图所示,则晶体Cu的堆积方式为面心立方最密堆积.
(4)若Cu单质的晶体密度为ρ g/cm3,Cu的相对原子质量为M g/mol,阿伏加德罗常数为NAmol-1,则Cu的原子半径为$\frac{\sqrt{2}}{4}×\root{3}{\frac{4M}{ρ{N}_{A}}}$cm.
(5)Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有16个铜原子.
分析 (1)根据原子核外电子排布规律,铁原子核外有26个电子;
(2)分子晶体的熔沸点较低;
(3)图所示晶胞属于面心立方最密堆积;
(4)利用均摊法计算该晶胞中铁原子个数,再结合密度公式进行计算;
(5)根据O数目和Cu2O中Cu和O的比例计算晶胞中Cu原子的数目.
解答 解:(1)Fe原子核外有26个电子,根据核外电子排布规律,Fe原子核外电子排布为[Ar]3d64s2 或1s22s22p63s23p63d64s2,Fe3+的外围电子排布式为3d5,
故答案为:3d5;
(2)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,
故答案为:分子晶体;
(3)图所示晶胞属于面心立方最密堆积,则晶体Cu的堆积方式为面心立方最密堆积,故答案为:面心立方最密堆积;
(4)一个Cu晶胞中Cu原子的数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量m=$\frac{M}{{N}_{A}}×4$,假设Cu的原子半径为r,晶胞体积V=$(\frac{4r}{\sqrt{2}})^{3}$,晶胞密度$ρ=\frac{m}{V}$,则r=$\frac{\sqrt{2}}{4}×\root{3}{\frac{4M}{ρ{N}_{A}}}$,
故答案为:$\frac{\sqrt{2}}{4}×\root{3}{\frac{4M}{ρ{N}_{A}}}$;
(5)该晶胞中O原子数为4×1+6×$\frac{1}{2}$+8×$\frac{1}{8}$=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,即为16个,
故答案为:16.
点评 本题涉及晶胞的计算、晶体类型的判断、阿伏伽德罗常数的有关计算等知识点的考查,难点是晶胞的计算,要求学生有丰富的空间想象能力及计算能力,难度较大.

 阅读快车系列答案
阅读快车系列答案| A. | 气态氢化物的热稳定性:X<W | |
| B. | 最高价氧化物对应水化物的酸性:W<Z | |
| C. | 电负性:Z<W | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
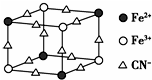
| A. | 该晶体属于离子晶体,M呈+2价 | |
| B. | 该晶体属于分子晶体,化学式为MFe2(CN)6 | |
| C. | 该晶体中与每个Fe3+距离相等且最近的CN-为12个 | |
| D. | 该晶体的一个晶胞中含有的M+的个数为4个 |
| A. | NaHSO4溶液 | B. | NaCl溶液 | C. | KAl(SO4)2溶液 | D. | KF溶液 |
| A. | MClx | B. | MCl2y/x | C. | MxCly | D. | MyClx |

| A. | 该有机物的化学式为:C29H44O | |
| B. | 牛式二烯炔醇能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol牛式二烯炔醇最多可与6molBr2发生加成反应 | |
| D. | 牛式二烯炔醇分子内能发生消去反应 |
 按要求回答下列问题:
按要求回答下列问题: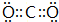 ,B与D形成的原子个数比为1:1的化合物乙的电子式是
,B与D形成的原子个数比为1:1的化合物乙的电子式是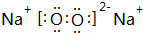 .
.