题目内容
下列实验操作现象与图象所示不相对应的是( )
A、 往AlCl3溶液中逐滴加入NaOH溶液至过量 |
B、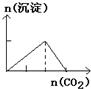 往澄清石灰水中缓慢通入CO2气体至过量 |
C、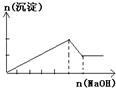 往含MgCl2、AlCl3各1mol的混合溶液中逐滴加入NaOH溶液至过量 |
D、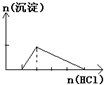 往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量 |
考点:镁、铝的重要化合物
专题:图示题,元素及其化合物
分析:A.氯化铝溶液中加入氢氧化钠溶液先生成沉淀,后沉淀溶解至最后消失,根据方程式判断前后两部分两部分消耗的氢氧化钠物质的量关系;
B.向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1;
C.AlCl3、MgCl2的混合溶液中加入过量NaOH溶液,先生成氢氧化镁、氢氧化铝两种沉淀,然后氢氧化铝与氢氧化钠反应使沉淀的量减少,但不会完全溶解;
D.往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量先产生沉淀,后沉淀溶解.
B.向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1;
C.AlCl3、MgCl2的混合溶液中加入过量NaOH溶液,先生成氢氧化镁、氢氧化铝两种沉淀,然后氢氧化铝与氢氧化钠反应使沉淀的量减少,但不会完全溶解;
D.往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量先产生沉淀,后沉淀溶解.
解答:
A.向AlCl3溶液中加入NaOH溶液至过量:AlCl3+3NaOH=Al(OH)3↓+AlCl3,产生沉淀,溶解沉淀需要1体积NaOH,所用NaOH溶液体积为3:1;A与图象相符,故A正确;
B.向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1;B与图象不符,故B错误;
C.往含MgCl2、AlCl3各1mol的混合溶液中逐滴加入NaOH溶液至过量:Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,先产生沉淀,后沉淀量减少但不会完全溶解,C与图象相符,故C正确;
D.往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量:NaOH+HCl=NaCl+H2O,NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,先产生沉淀,后沉淀溶解,D与图象相符,故D正确;
故选B.
B.向石灰水中通入二氧化碳:CO2+Ca(OH)2=CaCO3↓+H2O,CaCO3+CO2+H2O=Ca(HCO3)2,先产生沉淀,后沉淀溶解,所用二氧化碳体积为1:1;B与图象不符,故B错误;
C.往含MgCl2、AlCl3各1mol的混合溶液中逐滴加入NaOH溶液至过量:Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,先产生沉淀,后沉淀量减少但不会完全溶解,C与图象相符,故C正确;
D.往NaOH和NaAlO2混合溶液中逐滴加入盐酸至过量:NaOH+HCl=NaCl+H2O,NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,Al(OH)3+3HCl=AlCl3+3H2O,先产生沉淀,后沉淀溶解,D与图象相符,故D正确;
故选B.
点评:本题考查加入试剂或通入气体的体积与产生沉淀的物质的量的关系,先写出有关的反应式,然后根据反应物的物质的量之比确定图象.

练习册系列答案
相关题目
胶体区别于其它分散系的本质特征是( )
| A、胶体有丁达尔效应 |
| B、胶体粒子带电荷 |
| C、胶体粒子不能穿过半透膜 |
| D、胶体粒子直径在1-100nm之间 |
下列物质的反应过程符合如图所示关系的是( )


| A、向CaCl2溶液中通入CO2至过量 |
| B、向澄清石灰水中通入CO2至过量 |
| C、向Na2SiO3溶液中通入CO2至过量 |
| D、AlCl3溶液滴加NaOH溶液至过量 |
已知:H+(aq)+OH- (aq)=H2O(l)△H=-57.3kJ?mol-1,分别向1L0.5moL.L-1的KOH溶液中加入:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应的中和热分别为△H1、△H2、△H3,他们的关系正确的是( )
| A、△H1>△H3>△H2=-57.3 kJ?mol-1 |
| B、△H2<△H1=-57.3 kJ?mol-1<△H3 |
| C、△H1>△H3=-57.3 kJ?mol-1>△H2 |
| D、△H1<△H3=-57.3 kJ?mol-1<△H2 |