题目内容
5.NA为阿伏加德罗常数的值,下列说法正确的是( )| A. | 1.5g甲基(-CH3)所含电子数目为NA | |
| B. | 标准状况下,11.2L苯中含有1.5NA 个碳碳双键 | |
| C. | 常温常压下,14 g乙烯和丙烯(C3H6)的混合气体中所含原子总数为3NA | |
| D. | 4.6 g Na与100 mL1.0 mol/L醋酸溶液反应,转移电子数目为0.1NA |
分析 A.1个甲基含有9个电子;
B.苯分子中不存在碳碳双键;
C.乙烯和丙烯的最简式为CH2,根据最简式计算出14g混合物中含有的原子总数;
D.钠与醋酸、水都反应,生成物中钠元素都是以+1价钠离子形式存在,生成1mol钠离子转移1mol电子.
解答 解:A.1.5g甲基(-CH3)物质的量为$\frac{1.5g}{15g/mol}$=0.1mol,含有电子数目为0.9mol,故A错误;
B.苯中不含有碳碳双键,故B错误;
C.14g乙烯和丙烯的混合气体含有1mol最简式为CH2,含有1mol碳原子和2mol氢原子,总共含有3mol原子,所含原子总数为3NA,故C正确;
D.4.6 g Na物质的量为$\frac{4.6g}{23g/mol}$=0.2mol,与100Lm1.0 mol/L醋酸溶液反应生成0.2mol钠离子,转移电子数目为0.2NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件应用,氧化还原反应转移电子数计算,明确以物质的量为核心的计算公式的解题关键,注意苯、烯烃结构特点,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
15.A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍.B在D中充分燃烧能生成其最高价化合物BD2.E+与D2-具有相同的电子数.A在F中燃烧,产物溶于水得到一种强酸.
(1)A在周期表位置第一周期第IA族,写出一种工业制备单质F的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应的化学方程式为Cl2+2Na2CO3+H2O═NaClO+NaCl+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如表:
a的化学式为NaH;b的化学式为Na2O2和Na2C2;c的电子式为 ,d是金属晶体
,d是金属晶体
(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为2mol.
(1)A在周期表位置第一周期第IA族,写出一种工业制备单质F的离子方程式:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为纯碱(或苏打),其水溶液与F单质反应的化学方程式为Cl2+2Na2CO3+H2O═NaClO+NaCl+2NaHCO3.
(3)由这些元素组成的物质,其组成和结构信息如表:
| 物质 | 组成和结构信息 |
| a | 含有A的二元离子化合物 |
| b | 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c | 化学组成为BDF2 |
| d | 只存在一种类型作用力且可导电的单质晶体 |
 ,d是金属晶体
,d是金属晶体(4)由A和B元素组成的二元化合物是 沼气的主要成分,其与氧气在酸性电解质溶液中组成燃料电池消耗标况下11.2L氧气时转移电子数为2mol.
16.从海水提取溴的过程中,吸收塔内溴蒸气和吸收剂SO2发生的化学反应为:Br2+SO2+2H2O=2HBr+H2SO4,下列说法正确的是( )
| A. | SO2在反应中被还原 | B. | Br2在反应中失去电子 | ||
| C. | Br2在反应中表现氧化性 | D. | 1mol氧化剂在反应中得到1mol电子 |
13.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1molFeCl2与1molCl2反应时转移的电子数为2NA | |
| B. | 2g H218O与D216O的混合物中所含电子数目为NA | |
| C. | 273K,101kPa下,28g乙烯与丙烯混合物中含有C-H键的数目为5NA | |
| D. | pH=1的H2SO3溶液10L,含H+的数目为2NA |
20.下列措施一定能使反应速率加快的是( )
| A. | 升高温度 | B. | 加入生成物 | ||
| C. | 缩小容器体积 | D. | 增加反应物的物质的量 |
10.由A、B、C、D四种金属按下表中装置进行实验.
根据实验现象回答下列问题:
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
| 装置 | 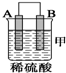 | 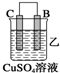 | 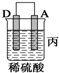 |
| 现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
①装置甲中作正极的是B (填“A”或“B”).
②装置乙溶液中Cu2+向C极移动(填“B”或“C”).
③装置丙中金属A上电极反应属于还原反应(填“氧化反应”或“还原反应”).
④四种金属活动性由强到弱的顺序是D>A>B>C.
17.用NA表示阿伏加德罗常数的值.下列说法正确的是( )
| A. | 0.1 mol氮气中所含的氮原子数是0.1NA | |
| B. | 标准状况下,2.24 L乙醇中所含的分子数是0.1NA | |
| C. | 1mol•L-1 氨水溶液中含NH4+的数目是NA | |
| D. | 24g镁和足量的盐酸反应,电子转移的数目是2NA |
14.可用于鉴别以下三种化合物的试剂组合是( )
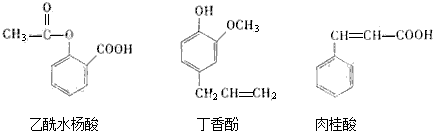
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④碳酸钠溶液.

①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④碳酸钠溶液.
| A. | ②与③ | B. | ③与④ | C. | ①与④ | D. | ②与④ |
6.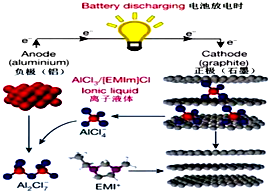 据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
 据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )
据2015年4月10日的报道,湖南大学 85后副教授鲁兵安参与斯坦福大学的团队刚刚发明出了一种“一分钟充满电”的新型铝离子电池.他们发现了一种新型石墨材料--泡沫石墨(graphite foam),泡沫石墨刚好可以充当电池的正极(负极用铝制成),而电解液则采用一种离子液体--即全由离子组成、室温下呈液态的离子化合物,具体成分为一种有机盐(化学表达式为[EMIm]Cl)与氯化铝的混合物.如图:关于该电池的说法不正确的是( )| A. | 放电时,铝电极的电极反应式为:Al+7AlCl4--3e-═4Al2Cl7- | |
| B. | [EMIm]Cl中既含离子键,又含共价键 | |
| C. | 电子流向为:石墨通过离子液体流向铝 | |
| D. | 充电时石墨电极的电极反应式为:Cn[AlCl4]-e-═Cn+AlCl4- |