题目内容
6.氨是合成硝酸、铵盐和氮肥的基本原料,回答下列问题:(1)实验室制取氨气的反应原理为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(2)氨的水溶液显弱碱性,其原因为NH3•H2O?NH4++OH-(用离子方程式表示),0.1mol•L-1的氨水中加入少量NH4Cl固体,溶液的pH降低(填“升高”或“降低”);
(3)硝酸铵加热分解可得到N2O和H2O,250℃时,硝酸铵在密闭容器中分解达到平衡,该分解反应的化学方程式为NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑,平衡常数表达式为K=c(N2O)×c2(H2O);.
分析 (1)铵盐和碱反应生成氨气,实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水;
(2)一水合氨为弱碱,溶于水存在部分电离,依据化学平衡原理解释加入NH4Cl固体后平衡移动方向以及pH的变化;
(3)依据所给的反应物和产物,结合元素守恒书写方程式即可,依据反应书写平衡常数表达式,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值.
解答 解:(1)实验室制备氨气是利用氯化铵和氢氧化钙固体加热生成氯化钙、氨气和水,反应的化学方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)一水合氨为弱碱,在水溶液中存在部分电离,电离出氢氧根离子使溶液显碱性,方程式为:NH3•H2O?NH4++OH-,向氨水中加入少量NH4Cl固体,铵根浓度增大,平衡左移,即氢氧根浓度减小,pH值降低,
故答案为:NH3•H2O?NH4++OH-;降低;
(3)硝酸铵分解生成N2O和H2O,达到平衡,说明为可逆反应,化学反应方程式为:NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑;化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则化学平衡常数为K=c(N2O)×c2(H2O),
故答案为:NH4NO3$\stackrel{△}{?}$N2O↑+2H2O↑;K=c(N2O)×c2(H2O).
点评 本题主要考查实验室制取氨气原理以及弱电解质的电离、电离平衡的影响因素,注意掌握氮及其化合物的性质,题目难度不大.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 干冰的升华 | |
| B. | 铝热反应 | |
| C. | 八水合氢氧化钡与氯化铵固体粉末混合 | |
| D. | 铜与浓硝酸反应 |
| A. | (CH3)2CHCl | B. | CH3C(CH3)2Br | C. | (CH3)3CCOOCH(CH3)2 | D. | CH3C(CH3)2CH2Br |
①非金属氧化物一定不是碱性氧化物
②金属氧化物一定是碱性氧化物
③电解质的电离需要通电
④Fe(OH)3、FeCl2、CaSiO3 都能直接用化合反应制备
⑤SO2能使酸性高锰酸钾溶液褪色,所以它具有漂白性
⑥SO2可形成酸雨,酸雨的PH小于5.6.
| A. | ①②④ | B. | ②⑤⑥ | C. | ①④⑥ | D. | 全部 |
| A. | H2 | B. | NO2 | C. | NO | D. | SO2 |
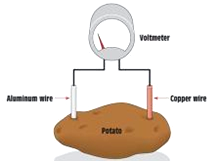 以色列研究人员宣布已研制出一种利用煮熟土豆发电的有机电池,具有构造简单、可持续利用等特点.图为土豆电池,这种绿色高效能的电池由锌、铜电极和煮熟的土豆片制成的.下列关于土豆电池叙述正确的是( )
以色列研究人员宣布已研制出一种利用煮熟土豆发电的有机电池,具有构造简单、可持续利用等特点.图为土豆电池,这种绿色高效能的电池由锌、铜电极和煮熟的土豆片制成的.下列关于土豆电池叙述正确的是( )| A. | 锌为电池的正极 | |
| B. | 铜极上发生氧化反应 | |
| C. | 该电池工作时电子由锌电极经外电路流向铜电极 | |
| D. | 该电池是将电能转化为生物质能 |
| A. |  | B. |  | C. |  | D. |  |