题目内容
17.某无色溶液中只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HCO3-、OH-、NO3-,已知该溶液能与铝反应放出氢气.试回答下列问题:(1)若反应后生成Al3+,则溶液中可能存在的离子有Na+、Mg2+,一定存在的离子有H+、Cl-,一定不存在的离子有Ag+、OH-、HCO3-、NO3-,反应的离子方程式为2Al+6H+=2Al3++3H2↑.
(2)若反应后生成AlO2-,则溶液中可能存在的离子有NO3-、Cl-,一定存在的离子有Na+、OH-,一定不存在的离子有Mg2+、H+、Ag+、HCO3-,反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 跟金属铝反应生成H2的溶液可能为酸溶液,也可能为碱溶液,当生成Al3+时,溶液为酸溶液,当生成AlO2-时,溶液为碱溶液,然后利用离子的共存来分析,并注意离子在水中的颜色.
解答 解:离子均为无色,所有离子均与无色透明溶液符合;铝既能与酸作用产生氢气,也能与碱作用产生氢气,
(1)溶液和铝粉反应后有Al3+生成,离子反应方程式为:2Al+6H+=2Al3++3H2↑,溶液显酸性,则HCO3-、OH-不存在,由于硝酸与金属反应一般没有氢气产生,因此也不存在NO3-,根据溶液不显电性,一定存在阴离子,即溶液中肯定有Cl-,而Ag+可与Cl-生成沉淀,说明原溶液中也不存在Ag+,即溶液中一定含有大量的H+、Cl-,可能含Na+、Mg2+,一定不能含有:Ag+、OH-、HCO3-、NO3-,
故答案为:Na+、Mg2+;H+、Cl-;Ag+、OH-、HCO3-、NO3-;2Al+6H+=2Al3++3H2↑;
(2)溶液和铝粉反应后有AlO2-生成,离子反应方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,溶液显碱性时,Mg2+、H+、Ag+、HCO3-不能存在,根据溶液不显电性,一定存在阳离子,即阳离子只有Na+,说明原溶液中的阴离子一定含OH-,可能含NO3-、Cl-,
故答案为:NO3-、Cl-;Na+、OH-;Mg2+、H+、Ag+、HCO3-;2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查常见离子的检验,为高频考点,把握溶液酸碱性判断、发生的离子反应、离子共存为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.短周期主族元素X、Y、Z、W原子序数依次增大,X原子最外层有7个电子,Y原子最外层电子数是最内层电子数的一半,Z最高正价是最低负价绝对值的3倍.下列叙述正确的是( )
| A. | Y的离子半径比X的离子半径大 | |
| B. | 化合物Y2Z中既有离子键、又有共价键 | |
| C. | Y、W最高价氧化物对应水化物的溶液均能溶解氧化铝 | |
| D. | 简单气态氢化物的稳定性由强到弱的顺序:Z、W、X |
12.下列气体不能用排水法收集的是( )
| A. | O2 | B. | NH3 | C. | CO | D. | H2 |
7.在PH=13的溶液中,下列各离子组可以大量共存的是( )
| A. | Na+、NO3-、H+、Ag+ | B. | K+、Fe3+、Cl-、SO42- | ||
| C. | K+、Ba2+、Cl-、CO32- | D. | Na+、AlO2-、K+、Cl- |
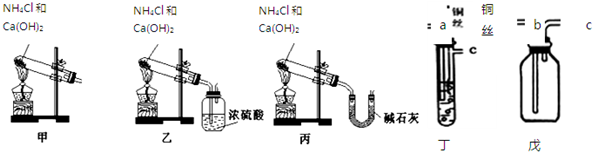
 2NH3.
2NH3.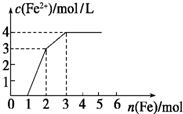 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.