题目内容
1.下列离子方程式的书写正确的是( )| A. | 铁和氯化铁溶液反应:Fe3++Fe═2Fe2+ | |
| B. | 醋酸和氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| C. | 实验室用MnO2和浓盐酸制取Cl2:MnO2+2H++2Cl-═Mn2++Cl2↑+H2O | |
| D. | 氢氧化铁和盐酸反应:H++OH-═H2O |
分析 A.电子、电荷不守恒;
B.反应生成醋酸钠和水;
C.电荷、原子不守恒;
D.氢氧化铁在离子反应中保留化学式.
解答 解:A.铁和氯化铁溶液反应的离子反应为2Fe3++Fe═3Fe2+,故A错误;
B.醋酸和氢氧化钠溶液反应的离子反应为CH3COOH+OH-═CH3COO-+H2O,故B正确;
C.实验室用MnO2和浓盐酸制取Cl2的离子反应为MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,故C错误;
D.氢氧化铁和盐酸反应的离子反应为3H++Fe(OH)3═Fe3++3H2O,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
12.用摩尔(mol)作为单位的基本物理量是( )
| A. | 长度 | B. | 质量 | C. | 数量 | D. | 物质的量 |
16.以下化学用语中,正确的是( )
| A. | 氯化钠的分子式:NaCl | B. | 苯的结构简式: | ||
| C. | 甲烷的电子式: | D. | 乙醛分子的结构式: |
6.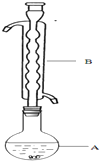 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过加热浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管_.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
则所得产品的纯度为103.2%,你认为影响纯度的主要原因是(不考虑操作引起的误差)含有的Na2SO3也会和I2发生反应,从而影响纯度.
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在100g水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.现实验室欲制取Na2S2O3•5H2O晶体(Na2S2O3•5H2O的分子量为248)
步骤如下:
①称取12.6g Na2SO3于烧杯中,溶于80.0mL水.
②另取4.0g硫粉,用少许乙醇润湿后,加到上述溶液中.
③(如图所示,部分装置略去),水浴加热,微沸,反应约1小时后过滤.
④滤液在经过加热浓缩、冷却结晶后析出Na2S2O3•5H2O晶体.
⑤进行减压过滤并干燥.
(1)仪器B的名称是球形冷凝管_.加入的硫粉用乙醇润湿的目的是增加反应物接触面积,提高反应速率.
(2)滤液中除Na2S2O3和可能未反应完全的Na2SO3外,最可能存在的无机杂质是Na2SO4.
(3)为了测产品的纯度,称取7.40g 产品,配制成250mL溶液,用移液管移取25.00mL于锥形瓶中,滴加淀粉溶液作指示剂,再用浓度为0.0500mol/L 的碘水,用酸式(填“酸式”或“碱式”)滴定管来滴定(2S2O32-+I2=S4O62-+2I-),滴定结果如下:
| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.30 | 31.12 |
| 第二次 | 0.36 | 31.56 |
| 第三次 | 1.10 | 31.88 |
10.向一定量的Cu、Fe2O3的混合物中加入300mL0.5mol/L的H2SO4溶液,恰好使混合物完全溶解,所得溶液中加入KSCN 溶液后无红色出现.则原混合物中Cu 和Fe2O3物质的量之比为( )
| A. | 2:1 | B. | 1:l | C. | 1:2 | D. | 无法计算 |
11.CaCO3溶于盐酸生成CO2:CaCO3+2HCl═CaCl2+CO2↑+H2O.则下列说法中,正确的是( )
| A. | 该反应的离子方程式为CO32-+2H+═CO2↑+H2O | |
| B. | 与同浓度的盐酸反应,块状大理石的反应速率比粉末状的大 | |
| C. | CaCO3溶于盐酸是因为H+破坏了CaCO3的沉淀溶解平衡,使其ksp增大 | |
| D. | CaCO3与适量的盐酸恰好完全反应所得溶液中c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) |
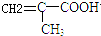 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$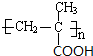 .
.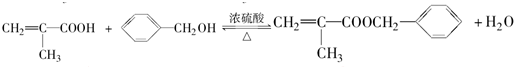 .
.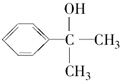 .
.