题目内容
13.下列关于电解质溶液的叙述正确的是( )| A. | 常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+) ①<②<③ | |
| B. | 在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
分析 A、物质的量相等的这几种溶液中,要比较铵根离子浓度大小,先比较盐中铵根离子的系数,系数越大,溶液中铵根离子浓度越大,相同系数的铵盐溶液,再根据溶液中其它离子是促进铵根离子水解还是抑制铵根离子水解判断即可;
B、能水解的盐促进水的电离,酸、碱抑制水的电离;
C、pH与体积均相同的盐酸和醋酸溶液,醋酸的物质的量较大;
D、硫化钠的水解程度大于NaHS的水解程度.
解答 解:A、②中铵根离子系数都是1,则硫酸氢铵中铵根离子浓度最小;②③中铵根离子系数都是2,其溶液中铵根离子浓度大于①溶液中铵根离子浓度,碳酸根离子促进铵根离子水解,则(NH4)2SO4溶液中铵根离子浓度大于(NH4)2CO3溶液中铵根离子浓度;所以铵根离子浓度②>③>①,故A错误;
B、硫酸铵水解促进水的电离,故B错误;
C、醋酸是弱酸,在pH相等的条件小,醋酸的浓度大,消耗的氢氧化钠多,故C错误;
D、硫化钠的水解程度大于NaHS的水解程度,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大,故D正确.
故选D.
点评 本题考查了水的电离以及盐的水解平衡的影响因素、盐的水解原理的应用等,侧重于学生的分析能力的考查,注意把握弱电解质的电离特点,题目难度中等.

练习册系列答案
相关题目
4.下列装置不能达到实验目的是( )


| A. | 用装置甲验证Na2O2与水的反应为放热反应 | |
| B. | 用装置乙验证铁和水蒸气的反应,方程式为3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2 | |
| C. | 丙装置,将蘸取氯化钾溶液的铂丝放在酒精灯上灼烧,检验钾元素 | |
| D. | 用装置丁比较碳酸钠和碳酸氢钠的热稳定性 |
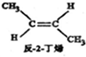
18.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( )
 ?
? ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1
 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
 ?
? ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 |
2.下列热化学方程式或离子方程式中,正确的是( )
| A. | 少量的Ba(OH)2溶液滴加到NaHCO3溶液中:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| B. | 0.01mol•L-1NH4Al(SO4)2溶液与0.02mol•L-1Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| C. | 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)=2CO(g)+O2(g)△H=+283.0 kJ•mol-1 |
 已知:2NO2(g)═N2O4(g),N2O4为无色气体.
已知:2NO2(g)═N2O4(g),N2O4为无色气体. G的一种合成路线如下:
G的一种合成路线如下:
 .
. .
. .
.
