题目内容
18.已知2-丁烯有顺、反两种异构体,在某条件下两种气体处于平衡,下列说法正确的是( ) ?
?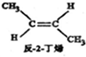 ,△H=-4.2kJ.mol-1
,△H=-4.2kJ.mol-1 (g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.
(g)+H2(g)=CH3CH2CH2CH2(g),△=-118.9kJ.mol-1.| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯小 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 (g)+H2(g)?CH3CH2CH2CH3(g),△H=-123.1kJ•mol-1 |
分析 A.能量越低越稳定;
B.若生成物相同,反应物的能量高,则放出的热量多;
C.生成正丁烷的反应为气体体积减小的放热反应;
D.盖斯定律指若一个反应可以分步进行,则各步反应的吸收或放出的热量总和与这个反应一次发生时吸收或放出的热量相同.
解答 解:A.顺-2-丁烯转化为反-2-丁烯放热,说明反-2-丁烯能量低,更稳定,故A正确;
B.等量的顺-2-丁烯具有更高的能量.所以顺-2-丁烯燃烧热更大,故B错误;
C.生成正丁烷的反应为气体体积减小的放热反应,所以减压向逆向移动,升温也向逆向移动,所以减压和升温不利于平衡向生成正丁烷反应方向移动,故C错误;
D.将下式-上式相加得到反-2-丁烯氢化的热化学方程式,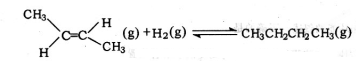 △H=-118.9kJ•mol-1-(-4.2kJ•mol-1)=-114.7kJ•mol-1,故D错误.
△H=-118.9kJ•mol-1-(-4.2kJ•mol-1)=-114.7kJ•mol-1,故D错误.
故选A.
点评 本题考查能量越低越稳定和盖斯定律、影响平衡的因素等,难度适中,注意掌握运用盖斯定律解题.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.在恒温、恒容条件下发生下列反应:2X2O5(g)═4XO2(g)+O2(g)△H>0,T温度下的部分实验数据为:
下列说法不正确的是( )
| t/s | 0 | 50 | 100 | 150 |
| c(X2O5)mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
| A. | T温度下的平衡常数为K=64(mol/L)3,100s时转化率为50% | |
| B. | 50s内X2O5分解速率为0.03 mol/(L•s) | |
| C. | T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2 | |
| D. | 若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都不变 |
6.下列依据热化学方程式得出的结论正确的是( )
| A. | 已知2SO2(g)+O2?2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 已知2C(s)+2O2(g)=2CO2 (g)△H1 2C(s)+O2(g)=2CO(g)△H2则△H1<△H2 | |
| D. | 已知H+(aq)+OH-(aq)=H2O(1)△H=-57.3kJ/mol,则任何酸碱中和的反应热均为57.3kJ |
13.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+) ①<②<③ | |
| B. | 在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |
3.下列离子方程式正确的是( )
| A. | NaClO溶液中通入少量SO2:ClO-+SO2+H2O=2H++SO42-+Cl- | |
| B. | FeCl3溶液中通入过量H2S气体:2Fe3++3H2S=2FeS↓+S↓+6H+ | |
| C. | Na2CO3溶液中通入少量Cl2:2CO32-+Cl2+H2O=ClO-+Cl-+2HCO3- | |
| D. | NaHSO3溶液中通入少量Cl2:HSO3-+Cl2+H2O=3H++SO42-+2Cl- |
7.称取14.00g某硫酸铁铵样品[aFe2(SO4)3•b(NH4)2SO4•cH2O],将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤,洗涤沉淀并烘干灼烧至恒重,得到1.60g固体;向另一份溶液中加入100mL 0.5mol/LBa(NO3)2溶液,恰好完全反应.则该硫酸铁铵样品的化学式为( )
| A. | 2Fe2(SO4)3•(NH4)2SO4•2H2O | B. | Fe2(SO4)3•2(NH4)2SO4•2H2O | ||
| C. | Fe2(SO4)3•2(NH4)2SO4•6H2O | D. | 2Fe2(SO4)3•(NH4)2SO4•6H2O |
