题目内容
2.列有关化学键的叙述,正确的一项是( )| A. | 离子化合物中一定含有离子键 | |
| B. | 单质的分子中均不存在化学键 | |
| C. | 含有共价键的化合物一定是共价化合物 | |
| D. | 任何物质内都含有化学键 |
分析 A、含有离子键的化合物是离子化合物;
B、单质分子有的存在化学键,有的不含化学键;
C、含有共价键的化合物不一定是共价键化合物;
D、稀有气体分子内不存在化学键.
解答 解:A、离子化合物中一定含有离子键,可能含有共价键,如KOH中含有离子键和共价键,故A正确;
B、单质分子中有的含有化学键,如H2,有的不含化学键,如稀有气体分子,故B错误;
C、含有共价键的化合物不一定是共价键化合物,可能是离子化合物,如NH4Cl,故C错误;
D、稀有气体分子内不存在化学键,故D错误;
故选A.
点评 本题考查了化学键和物质的关系,注意不是所有的物质都含有化学键,如稀有气体分子中不含化学键.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
10.25℃时,在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | PH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | c(Fe3+)=0.1mol/L的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | c(H+)/c(OH-)=1012的溶液中:NH4+、Al3+、NO3-、Cl- | |
| D. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
17.下列有关化学研究的正确说法是( )
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律 | |
| C. | 决定化学反应速率的最主要因素:反应物自身的性质 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
7.常温下,下列溶液中,能大量共存的一组离子是( )
| A. | pH=1的溶液中:NH4+、Fe2+、SO42-、Cl- | |
| B. | 能使酚酞试液变红的溶液:Na+、K+、HCO3-、S2- | |
| C. | c(Fe3+)=0.1 mol•L-1的溶液中:Na+、I-、SCN-、SO42- | |
| D. | 由水电离出的c(H+)=1.0×10-13 mol•L-1的溶液中:Na+、HCO3-、Cl-、Br- |
11.下列叙述正确的是( )
| A. | CH3COONH4是弱电解质 | |
| B. | 10 mL 0.02 mol•L-1HCl溶液与10 mL 0.02 mol•L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 | |
| C. | 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) | |
| D. | 用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液时,读取滴定管终点读数时,仰视刻度线引起测量结果偏低 |
12.下列说法错误的是( )
| A. | 蒸干AlCl3溶液可得AlCl3固体 | |
| B. | 向FeCl3溶液中加少量盐酸,抑制Fe3+水解 | |
| C. | 用纯碱溶液清洗油污时,加热可以增强其去污力 | |
| D. | 除去MgCI2酸性溶液中的Fe3+,可在加热搅拌的条件下加入MgCO3 |
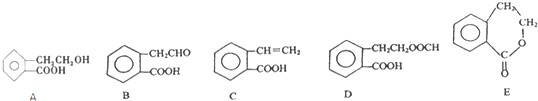
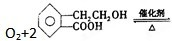 2
2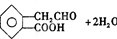
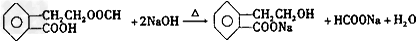 .
.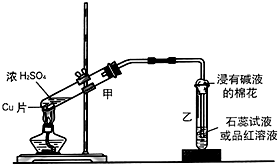 实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
实验室常用下列装置来进行铜跟浓硫酸反应等一系列实验.
 .
.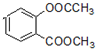 +3NaOH→CH3COONa+CH3OH+
+3NaOH→CH3COONa+CH3OH+ +H2O.
+H2O.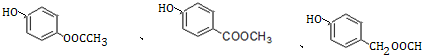 .
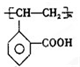
. )是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).
)是一种重要的有机合成中间体.试写出以苯、甲苯为原料制取该化合物的合成路线流程图(无机原料任用).