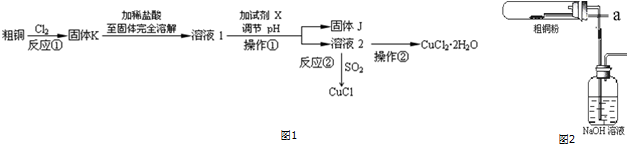
题目内容
1.设NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | H2SO4的摩尔质量是98g | |
| B. | 1mol O2的体积是22.4L | |
| C. | 18g H2O含有的原子总数为3NA | |
| D. | 0.1 mol•L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol•L-1 |
分析 A、摩尔质量的单位为g/mol;
B、氧气所处的状态不明确;
C、求出水的物质的量,然后根据水为三原子分子来分析;
D、在氯化钡溶液中,氯离子的浓度是氯化钡浓度的2倍.
解答 解:A、摩尔质量的单位为g/mol,故硫酸的摩尔质量为98g/mol,故A错误;
B、氧气所处的状态不明确,故1mol氧气的体积无法计算,故B错误;
C、18g水的物质的量为1mol,而水为三原子分子,故1mol水中含3NA个原子,故C正确;
D、在氯化钡溶液中,氯离子的浓度是氯化钡浓度的2倍,故此溶液中氯离子的浓度为0.2mol/L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.2015年8月12日天津塘沽发生大型爆炸事件造成多人伤亡,专家估测其能量不亚于24吨TNT(2、4、6-三硝基甲苯)爆炸发出的能量,同时现场发现有大量的碱、氰化钠等化学物质.下列说法正确的是( )
| A. | 爆炸一定都属于化学变化 | |
| B. |  盛放氰化钠的容器上应贴有如图所示的安全标识 | |
| C. | 生石灰烧伤应立即用大量的水冲洗并涂上中和剂硼酸 | |
| D. | TNT爆炸的产物只有CO、CO2及氮氧化物 |
6.高温下,某反应达到平衡,平衡常数K=$\frac{c(CO)•c({H}_{2}O)}{c(C{O}_{2})•c({H}_{2})}$,保持其他条件不变,温度升高,H2浓度减小.下列说法正确的是( )
| A. | 该反应化学方程式为CO+H2O?CO2+H2 | |
| B. | 该反应为吸热反应 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 无论采取怎样的措施该体系中混合气体的平均分子量都不会发生改变 |
13.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
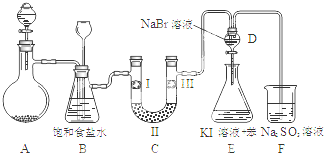
(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d.
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为深棕红色,说明氯的非金属性大于溴.打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能说明溴的非金属性强于碘 (填“能”或“不能”),原因是过量的Cl2也可将I-氧化为I2.

(1)制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象锥形瓶中液面下降,长颈漏斗中液面上升.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入d.
| a | b | c | d | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
10.某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:下列叙述错误的是( )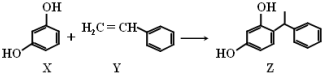

| A. | X、Y和Z均能使溴水褪色 | |
| B. | X和Z均能与Na2CO3溶液反应 | |
| C. | Y分子中所有原子可能在同一平面上 | |
| D. | Z能发生加成反应、取代反应,但不能发生氧化反应 |
11.现有NO、NO2、O3三种气体,它们含有的氧原子数目相同,则三种气体的物质的量之比为( )
| A. | 6:3:2 | B. | 3:2:1 | C. | 1:2:3 | D. | 1:1:1 |