题目内容
16.煤、石油、天然气等能源以热的形式给人们需要的能量.试以它们各自的主要成份C、CnH2n+2和CH4代表,写出它们燃烧过程的化学方程式.指出它们的质量相同时,哪一种燃料对环境造成的负面影响(温室效应)最小.分析 C燃烧生成二氧化碳,CnH2n+2和CH4燃烧生成二氧化碳和水,质量相同时,生成二氧化碳越少,则对环境造成的负面影响越小,可根据含氢量判断,以此解答该题.
解答 解:C燃烧生成二氧化碳,反应的化学方程式为C+O2=CO2,CnH2n+2和CH4燃烧生成二氧化碳和水,燃烧的化学方程式为CnH2n+2+(n+$\frac{2n+2}{4}$)O2=CO2+(n+1)H2O,CH4+2O2=CO2+2H2O,质量相同时,生成二氧化碳越少,则对环境造成的负面影响越小,CH4的含氢量最大,则生成二氧化碳最少,对环境污染最小,
答:它们燃烧过程的化学方程式分别为C+O2=CO2、CnH2n+2+(n+$\frac{2n+2}{4}$)O2=CO2+(n+1)H2O、CH4+2O2=CO2+2H2O,CH4对环境造成的负面影响(温室效应)最小.
点评 本题考查环境问题,为高频考点,侧重于化学与生后、生产的考查,有利于培养学生良好的科学素养,树立环保意识,难度不大,注意相关基础的积累.

练习册系列答案
相关题目
6.甲酸钙广泛用于食品、化工、石油等工业生产上,300~400℃左右分解.
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发.
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
请补充完整由碳酸钙制备甲酸钙晶体的实验方案:称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用,步骤2.用稍过量硝酸溶解碳酸钙样品;
步骤3.用石灰水调整溶液pH=5;
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH7~8;充分搅拌,所得溶液经蒸发结晶、趁热过滤、洗涤干燥得甲酸钙晶体;
(提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水)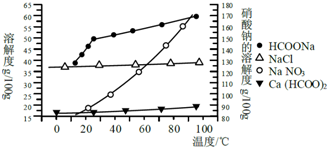
Ⅰ、实验室制取的方法之一是:Ca(OH)2+2HCHO+H2O2=Ca(HCOO)2+2H2O+H2↑
实验室制取时,将工业用氢氧化钙和甲醛依次加入到质量分数为30-70%的过氧化氢溶液中(投料物质的量之比依次为1:2:1.2),最终可得到质量分数98%以上且重金属含量极低的优质产品.
(1)过氧化氢比理论用量稍多,其目的是使甲醛充分氧化,提高甲醛的利用率和产品纯度.
(2)反应温度最好控制在30-70℃之间,温度不易过高,其主要原因是防止H2O2分解和甲醛挥发.
(3)制备时在混合溶液中要加入微量硼酸钠抑制甲醛发生副反应外,还要加入少量的Na2S溶液,加硫化钠的目的是除去重金属离子.
(4)实验时需强力搅拌45min,其目的是使反应物充分接触,提高产率;结束后需调节溶液的pH 7~8,其目的是防止甲酸钙水解.最后经结晶分离、干燥得产品.
Ⅱ、某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3)为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤3.用石灰水调整溶液pH=5;
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH7~8;充分搅拌,所得溶液经蒸发结晶、趁热过滤、洗涤干燥得甲酸钙晶体;
(提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水)

1.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | H2SO4的摩尔质量是98g | |
| B. | 1mol O2的体积是22.4L | |
| C. | 18g H2O含有的原子总数为3NA | |
| D. | 0.1 mol•L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol•L-1 |
8.砹是原子序数最大的卤族元素,推测砹和砹的化合物不可能具有的性质是( )
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | 砹化氢很稳定 | D. | 砹化银不溶于水 |
5.下列说法正确的为( )
| A. | 同温同压下,相同体积的物质,其物质的量一定相等 | |
| B. | 标况下气体的摩尔体积约为22.4升 | |
| C. | 1L0.5mol/LFeCl3的溶液与0.2L1mol/LKCl溶液中Cl-数目之比为15:2 | |
| D. | 100mL1mol/LNaCl溶液与50mL1mol/LAlCl3溶液中Cl-物质的量浓度相等 |
6.下列说法正确的是( )

| A. | 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△=-221.0kJ/mol,则碳的燃烧热为110.5kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g)△=-akJ/mol II:  且a、b、c均大于零,则断开1mol H-Cl键所需的能量为(-a-b-c)kJ/mol |