题目内容
11.现有NO、NO2、O3三种气体,它们含有的氧原子数目相同,则三种气体的物质的量之比为( )| A. | 6:3:2 | B. | 3:2:1 | C. | 1:2:3 | D. | 1:1:1 |
分析 设三种气体都含有1mol氧原子,依据NO、NO2、O3三种气体所含氧原子个数计算三种气体的物质的量.
解答 解:设NO、NO2、O3三种气体,它们都含有1mol氧原子,则NO、NO2、O3三种气体的物质的量分别为1mol、0.5mol、$\frac{1}{3}$mol,即物质的量之比为6:3:2,
故选:A.
点评 本题考查物质的量有关计算,熟悉三种气体的结构组成是解题关键,题目难度不大.

练习册系列答案
相关题目
1.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | H2SO4的摩尔质量是98g | |
| B. | 1mol O2的体积是22.4L | |
| C. | 18g H2O含有的原子总数为3NA | |
| D. | 0.1 mol•L-1 BaCl2溶液中,Cl-的物质的量浓度为0.1 mol•L-1 |
19.下列各组物质相互反应时,改变反应物的用量或反应条件,不会影响生成物的是( )
| A. | 碳酸钠与稀盐酸 | B. | 过氧化钠与二氧化碳 | ||
| C. | 氢氧化钠与二氧化碳 | D. | 钠与氧气 |
6.下列说法正确的是( )
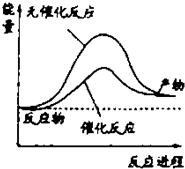

| A. | 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△=-221.0kJ/mol,则碳的燃烧热为110.5kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知I:反应H2(g)+Cl2(g)=2HCl(g)△=-akJ/mol II:  且a、b、c均大于零,则断开1mol H-Cl键所需的能量为(-a-b-c)kJ/mol |
16.下列气态氢化物的稳定性由大到小的排列须序正确的是( )
| A. | NH3、PH3、AsH3 | B. | SiH4、PH3、H2S | C. | HI、HBr、HCl | D. | H2S、HCl、AsH3 |
3.下列说法正确的是( )
| A. | 金属比非金属易失电子,所以金属可以置换非金属,而非金属不能置换金属 | |
| B. | 变价金属一定是过渡元素 | |
| C. | 不含金属元素的化合物也可能是离子化合物 | |
| D. | 显酸性的溶液中溶质只能是酸或强酸弱碱盐 |
20.已知下表中的四个热化学方程式,
(1)氢气的燃烧热是285.8 kJ•mol-1,丙烷的燃烧热是2221.5 kJ•mol-1.
(2)氢气作为燃料的主要优点是燃烧热值高,燃烧产物不污染环境.
| 嫦娥一号 | 液氢(H2) | ①2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol-1 ②2H2(l)+O2(l)=2H2O(g)△H=-482.6kJ•mol-1 |
| 祥云火炬 | 丙烷 (C3H8) | ③C3H8(l)+5O2(g)=3CO2(g)+4H2O(g)△H=-2013.8kJ•mol-1 ④C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=-2221.5kJ•mol-1 |
(2)氢气作为燃料的主要优点是燃烧热值高,燃烧产物不污染环境.
1.NA代表阿伏加德罗常数.下列有关叙述正确的是(Fe-56 O-16)( )
| A. | 标准状况下,2.24LH2O含有的分子数等于0.1NA | |
| B. | 标准状况下,2.24L Cl2通入足量NaOH溶液中,反应转移电子的数目为0.1NA | |
| C. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 18g重水(D2 O)所含的电子数为10NA |