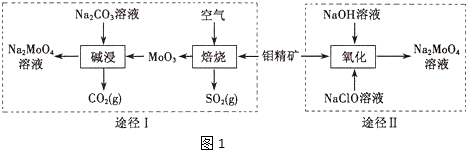
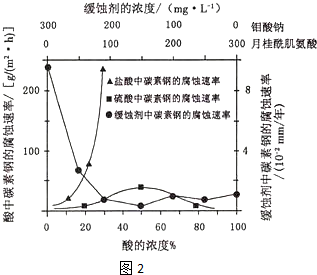
题目内容
17.在一定温度下,向aL密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(s)+2Y(g)?2Z(g),能判断该反应达平衡状态的是( )| A. | 容器内气体压强不随时间变化 | |
| B. | 容器内气体密度不随时间变化 | |
| C. | 容器内X、Y、Z的浓度之比为1:2:2 | |
| D. | X的消耗速率和Z的生成速率之比为1:2 |
分析 由X(s)+2Y(g)?2Z(g)可知,该反应前后的气体化学计量数之和相等,然后根据达到平衡时,正逆反应速率相等,但不等于零,各物质的浓度不再改变来解答.
解答 解:A.反应前后的气体的化学计量数之和相等,容器内的压强是个定值,始终不变,所以不能确定达到平衡,故A错误;
B.依据ρ=$\frac{m(g)}{V}$,容器的体积不变,即V不变,而混合气体的质量随着反应方向不同始终变化,所以则ρ在未达到平衡前始终变化,当ρ不变时,可以说明反应达到平衡,故B正确;
C.容器内X、Y、Z的浓度之比为1:2:2,不能确定各物质的浓度不变,不能确定是否达到平衡状态,故C错误;
D.X的消耗速率和Z的生成速率都代表正方向速率,不能确定V(正)与V(逆)是否相等,所以不能确定是否达到平衡状态,故D错误;
故选:B.
点评 本题考查化学平衡状态的判断,正逆反应速率相等,各组分浓度不变,达到了平衡状态,注意所选取的量必须是变量,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.Cl2是纺织工业常用的漂白剂,Na2S2O3可作为漂白布匹后的“脱氯剂”.S2O32-和Cl2反应的产物之一为SO42-.下列说法不正确的是( )
| A. | 该反应中的还原剂是S2O32- | |
| B. | 该反应的氧化产物是Cl- | |
| C. | 上述反应中,每生成1 mol SO42-,可脱去2 mol Cl2 | |
| D. | 根据该反应可判断氧化性:Cl2>SO42- |
8.下列物质中,能够导电的电解质是( )
| A. | 铜丝 | B. | 熔融的MgCl2 | C. | NaCl溶液 | D. | SO3 |
12.反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
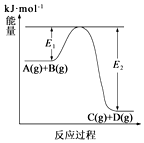

| A. | 上述反应为吸热反应 | B. | 上述反应的△H=E1kJ•mol-1 | ||
| C. | A(g)的能量一定大于C(g) | D. | 反应物的总焓大于反应产物的总焓 |
2.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 1 mol Cl2作为氧化剂得到的电子数为NA | |
| B. | 在0℃,101 kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3 NA | |
| D. | 将0.1mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA |
6.下列盐,既可以用“碱性氧化物+酸”制取,也可以用“酸性氧化物+碱”制取的是( )
| A. | KCl | B. | Na2S | C. | (NH4)2SO4 | D. | BaSO4 |