题目内容
20.下列装置及相应操作能达到实验目的是( )| A. | 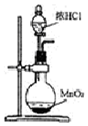 用如图装置制取氯气 | |
| B. | 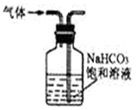 用如图装置除去CO2中的少量SO2气体 | |
| C. | 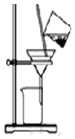 用如图装置分离饱和Na2CO3溶液中的NaHCO3晶体 | |
| D. | 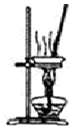 用如图装置将MgCl2.6H2O加热得到MgCl2 |
分析 A.浓盐酸与二氧化锰制备氯气,需要加热;
B.洗气时导管长进短出;
C.分离饱和Na2CO3溶液中的NaHCO3晶体,利用过滤法;
D.水解生成的盐酸易挥发.
解答 解:A.浓盐酸与二氧化锰制备氯气,需要加热,图中缺少酒精灯,故A错误;
B.洗气时导管长进短出,图中气体的进入方向不合理,故B错误;
C.分离饱和Na2CO3溶液中的NaHCO3晶体,利用过滤法,图中过滤装置可分离,故C正确;
D.水解生成的盐酸易挥发,不能蒸发制备晶体,应选冷却结晶法,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质制备实验、混合物分离提纯、实验装置、实验基本操作和基本技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
10. 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O).下列说法正确的是( )| A. | a电极的反应为:3CO2+18H++18e-=C3H8O+5H2O | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1molO2,有44gCO2被还原 | |
| D. | 该装置将化学能转化为光能和电能 |
8.下列物质中,能够导电的电解质是( )
| A. | 铜丝 | B. | 熔融的MgCl2 | C. | NaCl溶液 | D. | SO3 |
15.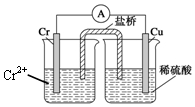 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )
 金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )
金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4).铜铬构成原电池如图所示,盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是( )| A. | 盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液 | |
| B. | 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 | |
| C. | 此过程中H+得电子,发生氧化反应 | |
| D. | 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中 |
12.反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( )
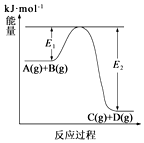

| A. | 上述反应为吸热反应 | B. | 上述反应的△H=E1kJ•mol-1 | ||
| C. | A(g)的能量一定大于C(g) | D. | 反应物的总焓大于反应产物的总焓 |
13.某烧碱溶液中含有少量杂质(不与盐酸反应),用标准液盐酸滴定氢氧化钠,测定其浓度.
(1)滴定:用酸式滴定管盛装c mol/L盐酸标准液.实验中选用酚酞作指示剂,当滴入最后一滴盐酸时,溶液由红色变为无色、且半分钟内不变色现象时表示滴定达到终点.实验有关数据记录如下:
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)c=$\frac{\frac{25.30mL+25.35,mL}{2}×1{0}^{-3}L×cmol/L}{V×1{0}^{-3}L}$.
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果无影响;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果偏低;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果偏高;
d.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果偏低.
(1)滴定:用酸式滴定管盛装c mol/L盐酸标准液.实验中选用酚酞作指示剂,当滴入最后一滴盐酸时,溶液由红色变为无色、且半分钟内不变色现象时表示滴定达到终点.实验有关数据记录如下:
| 滴定 序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | V | 0.50 | 25.80 | 25.30 |
| 2 | V | 6.00 | 31.35 | 25.35 |
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果无影响;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果偏低;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果偏高;
d.滴加盐酸速度过快,未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果偏低.