题目内容
12.下列关于化学式为[TiCl(H2O)5]Cl2•H2O的配合物的说法中正确的是( )| A. | 配体是Cl-和H2O,配位数是9 | |
| B. | 中心离子是Ti3+,配离子是[TiCl(H2O)5]2+ | |
| C. | 内界和外界中的Cl-的数目比是 2:1 | |
| D. | 加入足量AgNO3溶液,所有Cl-均被完全沉淀 |
分析 配合物也叫络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成,配合物中中心原子提供空轨道,[TiCl(H2O)5]Cl2•H2O,配体Cl、H2O,提供孤电子对;中心离子是Ti4+,配合物中配位离子Cl-不与Ag+反应,外界离子Cl-离子与Ag+反应,据此分析解答.
解答 解:A.配合物[TiCl(H2O)5]Cl2•H2O,配位体是Cl和H2O,配位数是6,故A错误;
B.中心离子是Ti3+,内配离子是Cl-,外配离子是Cl-,配离子是[TiCl(H2O)5]2+,故B正确;
C.配合物[TiCl(H2O)5]Cl2•H2O,内配离子是Cl-为1,外配离子是Cl-为2,内界和外界中的Cl-的数目比是1:2,故C错误;
D.加入足量AgNO3溶液,外界离子Cl-离子与Ag+反应,内配位离子Cl-不与Ag+反应,故D错误;
故选B.
点评 本题考查配合物的成键情况,注意配体、中心离子、外界离子以及配位数的判断,把握相关概念,特别注意配体和外界离子的区别,题目难度中等.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
20.该物质最多有几个碳原子共面( )


| A. | 6 | B. | 7 | C. | 8 | D. | 9 |
17.已知乙酸和乙酸乙酯的混合物中含H质量分数为7.8%,则其中含氧质量分数是( )
| A. | 45.4% | B. | 49.8% | C. | 51.4% | D. | 15.6% |
4.在一定温度下,向某固定容积的密闭容器中加入1mol N2和3mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g).此反应达到平衡状态的标志是( )
| A. | 容器内气体密度不再发生变化 | |
| B. | 容器内各物质的浓度不再发生变化 | |
| C. | v正(H2)=v逆(NH3) | |
| D. | 单位时间消耗0.1mol N2的同时生成0.2mol NH3 |
1.下列属于氧化还原反应的是( )
| A. | Na2O+H2O═2NaOH | B. | Cl2+H2O═HCl+HClO | ||
| C. | H2SO4+Na2SO3=Na2SO4+SO2↑+H2O | D. | FeS+2HCl═FeCl2+H2S↑ |
2.下列各组物质中,都属于混合物的是( )
| A. | 石灰水、水 | B. | 干冰、冰水混合物 | ||
| C. | 石墨、铁矿石 | D. | 不锈钢菜刀、食用醋 |
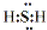 ;
;
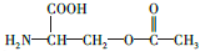 .
. .
.