题目内容
18.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol•L-1 NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )| A. | 60 mL | B. | 90 mL | C. | 120 mL | D. | 45 mL |
分析 Cu与硝酸反应生成硝酸铜与氮的氧化物,氮的氧化物与氧气、水反应又得到硝酸,反应后溶液中加入NaOH溶液生成Cu(OH)2沉淀,纵观整个过程,Cu提供电子等于氧气获得电子等于Cu(OH)2中氢氧根离子物质的量.
解答 解:Cu与硝酸反应生成硝酸铜与氮的氧化物,氮的氧化物与氧气、水反应又得到硝酸,反应后溶液中加入NaOH溶液生成Cu(OH)2沉淀,纵观整个过程,Cu提供电子等于氧气获得电子等于Cu(OH)2中氢氧根离子物质的量,则n(NaOH)=n(OH-)=$\frac{3.36L}{22.4L/mol}$×4=0.6mol,则消耗NaOH溶液的体积是$\frac{0.6mol}{5mol/L}$=0.12L=120mL,
故选:C.
点评 本题考查混合物有关计算,侧重考查学生分析计算能力,分析整个过程利用守恒法进行解答,难度中等.

练习册系列答案
相关题目
8.判断下列反应属于氧化还原反应的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | 2Mg+O2 $\frac{\underline{\;点燃\;}}{\;}$2MgO | ||
| C. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | D. | Cu(OH)2 $\frac{\underline{\;△\;}}{\;}$CuO+H2O |
9.下列化学反应中,既属于四种基本反应类型又属于氧化还原反应的是( )
| A. | NH4Cl+NaOH$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O+NaCl | B. | 3CO+Fe2O3$\frac{\underline{\;△\;}}{\;}$2Fe+3CO2 | ||
| C. | Cl2+2KBr═Br2+2KCl | D. | NH3+CO2+H2O═NH4HCO3 |
8.10g镁铝合金与足量的氢氧化钠溶液反应后,生成气体3.36L(标准状况),则此合金中含镁的质量分数为( )
| A. | 35.6% | B. | 27% | C. | 10% | D. | 73% |
 W、X、Y、Z分别为H、C、N、O元素.
W、X、Y、Z分别为H、C、N、O元素.
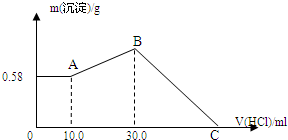 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生0.58g白色沉淀,再向所得悬浊液中逐滴加入0.5mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示.