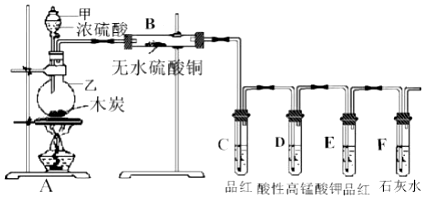
题目内容
16.把1.92gCu投入到一定量的浓硝酸中,充分反应,产生1.12L气体(标准状况).计算参加反应的硝酸的物质的量.分析 发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,由Cu原子守恒可知,n(Cu)=n[Cu(NO3)2],由N原子守恒可知n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2),以此来解答.
解答 解:n(Cu)=$\frac{1.92g}{64g/mol}$=0.03mol,n(气体)=$\frac{1.12L}{22.4L/mol}$=0.05mol,
发生Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,
由N原子守恒可知n(HNO3)=2n[Cu(NO3)2]+n(NO)+n(NO2),
则参加反应的硝酸的物质的量为0.03mol×2+0.05mol=0.11mol,
答:参加反应的硝酸的物质的量为0.11mol.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应或守恒法计算为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
6.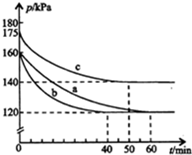 在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )
在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )
 在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )
在容积为2L的密闭容器中进行反应:AX3(g)+X2(g)?AX5(g)△H=QkJ/mol,起始时AX3和X2均为1.0mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.下列有关说法不正确的是( )| A. | Q<0 | |
| B. | 与实验a相比,实验b加入了催化剂 | |
| C. | 实验b条件下,该反应的平衡常数K=2 | |
| D. | 实验c从反应开始至达到平衡时的平均反应速率为v(AX5)=4.0×10-3mol/(L•min) |
5.实验室除去硝基苯中的氮氧化物杂质时用不到的仪器是( )
| A. | 漏斗 | B. | 分液漏斗 | C. | 烧杯 | D. | 铁架台 |
6.根据所给的信息和标志,判断下列说法不正确的是( )
| A | B | C | D |
 《神农本草经》记载,麻黄能“止咳逆上气” |  84消毒液主要成分是NaClO |  易拉罐主要成分是金属铝 |  贴有该标志的物品是可回收物 |
| 古代中国人已用麻黄治疗咳嗽 | 用于杀菌消毒和衣物的洗涤漂白 | 不可以用氢氧化钠溶液将其溶解 | 废纸、塑料、玻璃、金属均可回收 |
| A. | A | B. | B | C. | C | D. | D |