题目内容
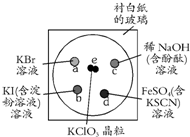 在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )| A、b处无色碘化钾溶液先变蓝色后变为无色,体现氯气和HClO的漂白性 |
| B、a处无色溴化钾溶液渐变成橙黄色,说明氯的非金属性强于溴 |
| C、c处氢氧化钠酚酞溶液的红色渐渐褪去,可能体现HCl的酸性或HClO的漂白性 |
| D、d处硫酸亚铁溶液呈红色,说明氯气氧化性强于Fe3+ |
考点:氯气的化学性质
专题:卤族元素
分析:氯酸钾与浓盐酸反应:ClO3-+6H++5Cl-=3Cl2↑+3H2O,生成的Cl2具有强氧化性,与溴化钾发生:2Br-+Cl2=2Cl-+Br2;与碘化钾发生:2I-+Cl2=I2+2Cl-;与Fe2+发生:2Fe2++Cl2=2Fe3++2Cl-;在碱性条件下自身发生氧化还原反应:2OH-+Cl2=Cl-+ClO-+H2O.
解答:
解:氯酸钾与浓盐酸反应:ClO3-+6H++5Cl-=3Cl2↑+3H2O,生成的Cl2具有强氧化性,
A、b处与碘化钾发生:2I-+Cl2=I2+2Cl-,无色碘化钾溶液逐渐变成蓝色,氯气的氧化性,后变为无色,是氯气和次氯酸的强氧化性氧化碘单质为碘酸盐,氯气无漂白性,故A错误;
B、a处与溴化钾发生2Br-+Cl2=2Cl-+Br2,无色溴化钾溶液逐渐变为橙色,说明氯气氧化性大于溴单质,氯的非金属性强于溴,故B正确;
C、c处氯气在碱性条件下自身发生氧化还原反应:2OH-+Cl2=Cl-+ClO-+H2O,氢氧化钠浓度逐渐减小,酚酞溶液的红色逐渐褪去,可能体现HCl的酸性或HClO的漂白性,故C正确;
D、d处与Fe2+发生:2Fe2++Cl2=2Fe3++2Cl-,溶液变红,氧化剂的氧化性大于氧化产物,说明氯气氧化性大于铁离子,故D正确;
故选A.
A、b处与碘化钾发生:2I-+Cl2=I2+2Cl-,无色碘化钾溶液逐渐变成蓝色,氯气的氧化性,后变为无色,是氯气和次氯酸的强氧化性氧化碘单质为碘酸盐,氯气无漂白性,故A错误;
B、a处与溴化钾发生2Br-+Cl2=2Cl-+Br2,无色溴化钾溶液逐渐变为橙色,说明氯气氧化性大于溴单质,氯的非金属性强于溴,故B正确;
C、c处氯气在碱性条件下自身发生氧化还原反应:2OH-+Cl2=Cl-+ClO-+H2O,氢氧化钠浓度逐渐减小,酚酞溶液的红色逐渐褪去,可能体现HCl的酸性或HClO的漂白性,故C正确;
D、d处与Fe2+发生:2Fe2++Cl2=2Fe3++2Cl-,溶液变红,氧化剂的氧化性大于氧化产物,说明氯气氧化性大于铁离子,故D正确;
故选A.
点评:本题考查氯气的性质,题目难度不大,本题注意氯气的强氧化性,以及一些粒子的还原性,注意反应原理和现象,学习中注重相关基础知识的积累.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知反应2I-+S2O82-═I2+2SO42-,加入淀粉溶液可观察到溶液变蓝色.反应速率可以用淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.20℃时得到如下实验数据:
分析上述数据,下列说法正确的是( )
| 实验编号 | C(I-)/mol?L | C(S2O82-)/mol?L | t/s |
| 1 | 0.040 | 0.040 | 88.0 |
| 2 | 0.080 | 0.040 | 44.0 |
| 3 | 0.080 | 0.080 | 22.0 |
| 4 | 0.160 | 0.020 | 44.0 |
| 5 | 0.120 | 0.040 | 29.3 |
| A、该实验的目的是研究 I- 与S2O82- 的浓度对反应速率的影响 |
| B、I-的浓度越大,反应速率越快 |
| C、S2O82- 的浓度越小,反应速率越快 |
| D、5个实验中,编号3对应浓度的实验,反应速率最快 |
一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2总量的是( )
①碳粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥水.
①碳粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥水.
| A、①③④ | B、①③⑤ |
| C、②④⑥ | D、③④⑤ |
下列试剂不能长期贮存在玻璃瓶中的是( )
| A、浓盐酸 | B、浓硫酸 |
| C、浓氢氧化钠溶液 | D、浓食盐水 |
下列有关化学用语中不能体现氮原子核外电子能量有差异的是( )
A、 |
B、 |
C、 |
| D、1s22s22p3 |
下列说法正确的是( )
| A、蔗糖水解只生成葡萄糖 |
| B、含有碳碳双键的有机物均存在顺反异构现象 |
| C、向混有苯酚的苯中加入金属Na有无色气体生成 |
| D、用酸性高锰酸钾溶液检验CH2=CHCHO中是否含有醛基放电充电 |
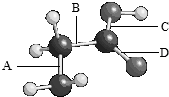 如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.
如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.