题目内容
下列有关化学用语中不能体现氮原子核外电子能量有差异的是( )
A、 |
B、 |
C、 |
| D、1s22s22p3 |
考点:电子式、化学式或化学符号及名称的综合
专题:化学用语专题
分析:电子式中只表示原子的最外层电子,不能体现出核外电子能力大小;而电子轨道排布式、电子排布式、原子结构示意图都能够根据电子所处的轨道、电子层等的不同判断电子能量的不同,据此进行解答.
解答:
解:A. :电子式只能表示出氮原子的最外层电子数,无法体现氮原子核外电子能量有差异,故A正确;
:电子式只能表示出氮原子的最外层电子数,无法体现氮原子核外电子能量有差异,故A正确;
B. :电子轨道排布式中,不同轨道的电子具有不同能量,能体现氮原子核外电子能量有差异,故B错误;
:电子轨道排布式中,不同轨道的电子具有不同能量,能体现氮原子核外电子能量有差异,故B错误;
C. :原子结构示意图中,不同的电子层上的电子具有不同能量,能体现氮原子核外电子能量有差异,故C错误;
:原子结构示意图中,不同的电子层上的电子具有不同能量,能体现氮原子核外电子能量有差异,故C错误;
D.1s22s22p3:该电子排布式中,电子能量大小为:1s<2s<2p,能体现氮原子核外电子能量有差异,故D错误;
故选A.
 :电子式只能表示出氮原子的最外层电子数,无法体现氮原子核外电子能量有差异,故A正确;
:电子式只能表示出氮原子的最外层电子数,无法体现氮原子核外电子能量有差异,故A正确;B.
 :电子轨道排布式中,不同轨道的电子具有不同能量,能体现氮原子核外电子能量有差异,故B错误;
:电子轨道排布式中,不同轨道的电子具有不同能量,能体现氮原子核外电子能量有差异,故B错误;C.
 :原子结构示意图中,不同的电子层上的电子具有不同能量,能体现氮原子核外电子能量有差异,故C错误;
:原子结构示意图中,不同的电子层上的电子具有不同能量,能体现氮原子核外电子能量有差异,故C错误;D.1s22s22p3:该电子排布式中,电子能量大小为:1s<2s<2p,能体现氮原子核外电子能量有差异,故D错误;
故选A.
点评:本题考查了原子结构、电子式、轨道排布式的表示方法及意义,题目难度不大,注意掌握常见化学用语的概念及表示方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列化学反应对应的离子方程式正确的是( )
| A、Cl2与H2O的反应:Cl2+H2O=2H++Cl-+ClO- |
| B、FeCl3溶液与KI溶液跑反应:Fe3++2I-=Fe2++I2 |
| C、Cu与稀硝酸的反应:Cu+2H++NO3-=Cu2++NO↑+H2O |
| D、Al2O3与NaOH溶液的反应:Al2O3+2OH-+3H2O=2[Al(OH)4]- |
下列说法正确的是( )
| A、水晶项链和卫生间地面的瓷砖都是硅酸盐制品 |
| B、用纯铝制造的高压锅更耐用 |
| C、玻璃是混合物,没有固定的熔点 |
| D、聚乙烯是热固性塑料,可用于制造电源插座 |
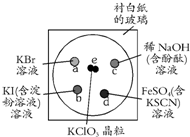 在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )| A、b处无色碘化钾溶液先变蓝色后变为无色,体现氯气和HClO的漂白性 |
| B、a处无色溴化钾溶液渐变成橙黄色,说明氯的非金属性强于溴 |
| C、c处氢氧化钠酚酞溶液的红色渐渐褪去,可能体现HCl的酸性或HClO的漂白性 |
| D、d处硫酸亚铁溶液呈红色,说明氯气氧化性强于Fe3+ |
下列各组物质由于温度不同而能发生不同氧化还原反应的是( )
| A、大理石与盐酸 |
| B、NaOH与AlCl3溶液 |
| C、Zn与H2SO4溶液 |
| D、Fe与浓硫酸 |
在FeBr2和FeI2混合溶液中逐渐通氯气,可能发生的反应的离子方程式是( )
| A、2Fe2++Cl2→2Fe3++2Cl - |
| B、2Fe2++2Br -+2I -+3Cl2→2Fe3++I2+Br2+6Cl - |
| C、2Fe2++4Br -+2I -+4Cl2→2Fe3++I2+2Br2+8Cl - |
| D、4Fe2++2Br -+2I -+4Cl2→4Fe3++I2+Br2+8Cl - |
下列有关实验操作正确的是( )
| A、用托盘天平称取10.50g的干燥的NaC1固体 |
| B、蒸馏时温度计水银球应插入混合液中且不与烧瓶底部接触 |
| C、配制浓硫酸和浓硝酸的混酸时,应将浓硫酸慢慢加到浓硝酸中,及时搅拌和冷却 |
| D、测溶液的pH需先用蒸馏水润湿pH试纸,再用干燥洁净的玻璃棒蘸溶液滴在试纸上,并与标准比色卡对照 |
某无色溶液能使紫色石蕊试液变红色,经实验测得该溶液中存在Ba2+和NO3-,则该溶液中还可能大量存在的离子组是( )
| A、NH4+、Mg2+、Cl-、K+ |
| B、Fe2+、Na+、Cl-、I- |
| C、SO42-、HCO3-、Cl-、K+ |
| D、AlO2-、Na+、Cl-、OH- |