题目内容
将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,则原氯化铝溶液和氢氧化钠溶液的物质的量浓度之比可能是( )
①1:3 ②2:3 ③1:7 ④2:7 ⑤任意比.
①1:3 ②2:3 ③1:7 ④2:7 ⑤任意比.
| A、⑤ | B、只有① | C、②④ | D、①③ |
考点:镁、铝的重要化合物
专题:计算题,元素及其化合物
分析:将氯化铝溶液和氢氧化钠溶液等体积混合,得到的沉淀物中含铝元素的质量与溶液中含铝元素的质量相等,沉淀为Al(OH)3,溶液中的铝可能为AlCl3也可能为:NaAlO2,
发生的反应分别为:Al3++3OH-═Al(OH)3↓或者Al3++3OH-═Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
发生的反应分别为:Al3++3OH-═Al(OH)3↓或者Al3++3OH-═Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O,结合反应的离子方程式分为两种情况讨论计算.
解答:
解:设AlCl3和NaOH的浓度分别为c1和c2,相同体积为V;
若NaOH不足,溶液中的铝为AlCl3,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则c1V-x=x,所以x=0.5c1V,消耗氢氧化钠3x,即1.5c1Vmol,所以1.5c1V=c2V,所以此时c1:c2=2:3;
若NaOH过量,生成NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,
又因为得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则说明第一步反应完后,生成的Al(OH)3有一半
(c1V)发生Al(OH)3+OH-=AlO2-+2H2O,
所以可求的NaOH的物质的量为:3c1V+0.5c1V=3.5c1V=c2V,所以c1:c2=2:7;
综上所述,氯化铝溶液和氢氧化钠溶液的物质的量浓度之比为:2:3或2:7;
故选C.
若NaOH不足,溶液中的铝为AlCl3,生成氢氧化铝白色沉淀发生反应:Al3++3OH-═Al(OH)3↓,设反应掉的铝离子物质的量为x,得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则c1V-x=x,所以x=0.5c1V,消耗氢氧化钠3x,即1.5c1Vmol,所以1.5c1V=c2V,所以此时c1:c2=2:3;
若NaOH过量,生成NaAlO2,此时参加反应的AlCl3的物质的量是c1Vmol,NaOH是3c1Vmol,生成c1V mol 的Al(OH)3,
又因为得到的沉淀物中铝元素的质量和溶液中铝元素的质量相等,则说明第一步反应完后,生成的Al(OH)3有一半
| 1 |
| 2 |
所以可求的NaOH的物质的量为:3c1V+0.5c1V=3.5c1V=c2V,所以c1:c2=2:7;
综上所述,氯化铝溶液和氢氧化钠溶液的物质的量浓度之比为:2:3或2:7;
故选C.
点评:本题考查了根据方程式进行计算,同时考查学生分析问题、解决问题能力,很多同学往往只考虑溶液中的铝元素为铝离子而漏掉为偏铝酸根离子而导致错误,为易错点,题目难度中等.

练习册系列答案
相关题目
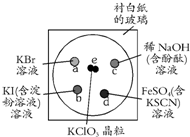 在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )| A、b处无色碘化钾溶液先变蓝色后变为无色,体现氯气和HClO的漂白性 |
| B、a处无色溴化钾溶液渐变成橙黄色,说明氯的非金属性强于溴 |
| C、c处氢氧化钠酚酞溶液的红色渐渐褪去,可能体现HCl的酸性或HClO的漂白性 |
| D、d处硫酸亚铁溶液呈红色,说明氯气氧化性强于Fe3+ |
某无色溶液能使紫色石蕊试液变红色,经实验测得该溶液中存在Ba2+和NO3-,则该溶液中还可能大量存在的离子组是( )
| A、NH4+、Mg2+、Cl-、K+ |
| B、Fe2+、Na+、Cl-、I- |
| C、SO42-、HCO3-、Cl-、K+ |
| D、AlO2-、Na+、Cl-、OH- |
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、0.5mol O2所含氧元素数为NA |
| B、0.2mol H2O所含的H原子数为0.2NA |
| C、0.1mol CH4所含电子数为NA |
| D、46克NO2和N2O4的混合物含有的分子数为NA |