题目内容
反应:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)已达平衡.若增大压强,平衡移动,但混合气体的平均相对分子质量不变.下列说法正确的是( )
| A、原混合气体的平均相对分子质量为30 |
| B、原混合气体的平均相对分子质量为28 |
| C、起始时,NH3与CO2的体积比为13:14 |
| D、起始时,NH3与CO2的体积比为14:15 |
考点:化学平衡的计算
专题:化学平衡专题
分析:由于该反应中,气体每减小2mol,生成1molCO(NH2)2是固体,气体质量减小60g,即减少的混合气体的平均相对分子质量为30,当起始混合气体的相对分子质量为30时,平衡正向移动,但混合气体的平均相对分子质量始终为30,所以加压时混合气体的平均相对分子质量不变;
A、因为原混合气体的平均相对分子质量为30,当减小的混合气体的平均相对分子质量为30时,平衡移动过程中,混合气体的平均相对分子质量不变;
B、因为原混合气体的平均相对分子质量为28,当减小的混合气体的平均相对分子质量为30时,剩余的混合气体的平均相对分子质量会减小;
C、NH3与CO2的体积比为13:14时,混合气体平均相对分子质量为
=31,当减小的混合气体的平均相对分子质量为30时,剩余的混合气体的平均相对分子质量会增大;
D、NH3与CO2的体积比为14:15时,混合气体平均相对分子质量为
=30.97,当减小的混合气体的平均相对分子质量为30时,剩余的混合气体的平均相对分子质量会增大,据此判断.
A、因为原混合气体的平均相对分子质量为30,当减小的混合气体的平均相对分子质量为30时,平衡移动过程中,混合气体的平均相对分子质量不变;
B、因为原混合气体的平均相对分子质量为28,当减小的混合气体的平均相对分子质量为30时,剩余的混合气体的平均相对分子质量会减小;
C、NH3与CO2的体积比为13:14时,混合气体平均相对分子质量为
| 13×17+14×44 |
| 13+14 |
D、NH3与CO2的体积比为14:15时,混合气体平均相对分子质量为
| 14×17+15×44 |
| 14+15 |
解答:
解:由于该反应中,气体每减小2mol,生成1molCO(NH2)2是固体,气体质量减小60g,即减少的混合气体的平均相对分子质量为30,当起始混合气体的相对分子质量为30时,平衡正向移动,但混合气体的平均相对分子质量始终为30,所以加压时混合气体的平均相对分子质量不变;
A、因为原混合气体的平均相对分子质量为30,增加压强,平衡正向移动,混合气体的量在减少,当减小的混合气体的平均相对分子质量为30时,平衡移动过程中,混合气体的平均相对分子质量不变,故A正确;
B、因为原混合气体的平均相对分子质量为28,增加压强,平衡正向移动,混合气体的量在减少,当减小的混合气体的平均相对分子质量为30时,剩余的混合气体的平均相对分子质量会减小,故B错误;
C、NH3与CO2的体积比为13:14时,混合气体平均相对分子质量为
=31,增加压强,平衡正向移动,混合气体的量在减少,当减小的混合气体的平均相对分子质量为30时,剩余的混合气体的平均相对分子质量会增大,故C错误;
D、NH3与CO2的体积比为14:15时,混合气体平均相对分子质量为
=30.97,增加压强,平衡正向移动,混合气体的量在减少,当减小的混合气体的平均相对分子质量为30时,剩余的混合气体的平均相对分子质量会增大,故D错误;
故选A.
A、因为原混合气体的平均相对分子质量为30,增加压强,平衡正向移动,混合气体的量在减少,当减小的混合气体的平均相对分子质量为30时,平衡移动过程中,混合气体的平均相对分子质量不变,故A正确;
B、因为原混合气体的平均相对分子质量为28,增加压强,平衡正向移动,混合气体的量在减少,当减小的混合气体的平均相对分子质量为30时,剩余的混合气体的平均相对分子质量会减小,故B错误;
C、NH3与CO2的体积比为13:14时,混合气体平均相对分子质量为
| 13×17+14×44 |
| 13+14 |
D、NH3与CO2的体积比为14:15时,混合气体平均相对分子质量为
| 14×17+15×44 |
| 14+15 |
故选A.
点评:本题主要考查平衡移动过程中平均相对分子质量的变化情况,难度较大,解题时要注意混合气体的总质量和总物质的量的变化关系.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
下列有关元素及其化合物的知识说法正确的是( )
| A、浓硝酸能与木炭反应,证明浓硝酸具有氧化性和酸性 |
| B、溴中溶有少量氯气,可用先加入少量溴化钠溶液再用酒精萃取的方法提纯 |
| C、高温下SiO2与Na2CO3生成Na2SiO3和CO2,证明硅酸酸性强于碳酸 |
| D、铵盐受热都能分解,但不一定都能生成氨气 |
氨水有下列平衡NH3.H2O?NH4++OH-,当其它条件不变时,改变下列条件,平衡向左移,且c(NH4+)增大的是( )
| A、加NaOH |
| B、加盐酸 |
| C、加NH4Cl |
| D、加同浓度氨水 |
在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O(HCl部分被氧化)的反应中,被还原的氯原子与被氧化的氯原子个数比为( )
| A、1:6 | B、6:1 |
| C、1:5 | D、5:1 |
在温度不变的条件下,密闭容器中发生如下反应:2SO2(g)+O2(g)
2SO3(g)下列叙述能够说明反应已经达到平衡状态的是( )
| V2O5 |
| 500℃ |
| A、容器中SO2、O2、SO3共存 |
| B、SO2 与SO3的浓度相等 |
| C、反应容器中压强不随时间变化 |
| D、容器中SO2、O2、SO3的物质的量之比为2:1:2 |
下列仪器中具有①溶解固体,②配制溶液,③加热较多量液体三种用途的是( )
| A、集气瓶 | B、量筒 | C、试管 | D、烧杯 |
下列溶液中可大量共存的离子组是( )
| A、Ba2+、Na+、NO3-、SO42- |
| B、K+、Ba2+、Cl-、NO3- |
| C、Na+、Al3+、OH-、K+ |
| D、Na+、Cl-、K+、Ag+ |
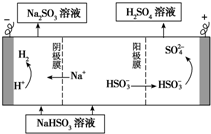 工业生产中用SO2为原料制取硫酸
工业生产中用SO2为原料制取硫酸