题目内容
氨水有下列平衡NH3.H2O?NH4++OH-,当其它条件不变时,改变下列条件,平衡向左移,且c(NH4+)增大的是( )
| A、加NaOH |
| B、加盐酸 |
| C、加NH4Cl |
| D、加同浓度氨水 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:其它条件不变时,改变下列条件,平衡向左移,且c(NH4+)增大,说明加入的物质中含有铵根离子,因为铵根离子浓度增大而导致平衡左移,据此分析解答.
解答:
解:A.向溶液中加入NaOH,溶液中c(OH-)增大,导致平衡左移,c(NH4+)减小,故A错误;
B.向溶液中加入HCl,H+和OH-反应生成H2O,导致平衡右移,与题意不符合,故B错误;
C.向溶液中加NH4Cl,NH4Cl电离导致溶液中c(NH4+)增大,则平衡左移,故C正确;
D.加同浓度氨水,氨水中NH3.H2O浓度不变,则平衡不移动,故D错误;
故选C.
B.向溶液中加入HCl,H+和OH-反应生成H2O,导致平衡右移,与题意不符合,故B错误;
C.向溶液中加NH4Cl,NH4Cl电离导致溶液中c(NH4+)增大,则平衡左移,故C正确;
D.加同浓度氨水,氨水中NH3.H2O浓度不变,则平衡不移动,故D错误;
故选C.
点评:本题考查弱电解质的电离,明确影响弱电解质电离的因素是解本题关键,知道改变条件时引起哪些物理量而导致平衡移动,侧重考查学生分析问题能力,题目难度不大.

练习册系列答案
相关题目
反应:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)已达平衡.若增大压强,平衡移动,但混合气体的平均相对分子质量不变.下列说法正确的是( )
| A、原混合气体的平均相对分子质量为30 |
| B、原混合气体的平均相对分子质量为28 |
| C、起始时,NH3与CO2的体积比为13:14 |
| D、起始时,NH3与CO2的体积比为14:15 |
用98%浓硫酸配制200mL 0.5mol?L-1的硫酸溶液,一定需要使用的玻璃仪器是①玻璃棒 ②烧杯 ③烧瓶 ④量筒 ⑤容量瓶( )
| A、①②③ | B、①②④⑤ |
| C、②③⑤ | D、③④⑤ |
 请按要求填空
请按要求填空
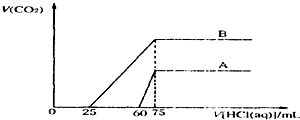 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.试回答下列间题:
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴加入0.1mol?L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.试回答下列间题: