题目内容
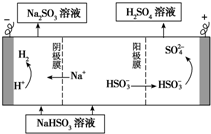 工业生产中用SO2为原料制取硫酸
工业生产中用SO2为原料制取硫酸①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触.请写出该电池的负极的电极反应式
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸.电解原理示意图如图所示.请写出开始时阳极反应的电极反应式
考点:电解原理
专题:电化学专题
分析:①依据原电池原理,负极是失电子发生氧化反应,二氧化硫失电子生成硫酸的过程;
②根据化合价变化判断阳极反应物质,写出阳极反应式.
②根据化合价变化判断阳极反应物质,写出阳极反应式.
解答:
解:①该原电池中,负极上失电子被氧化,二氧化硫到硫酸,硫的化合价升高,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,所以负极上的电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
故答案为:SO2-2e-+2H2O═SO42-+4H+;
②电解池中阳极和电源正极相连,失去电子,发生氧化反应,电解NaHSO3溶液可制得硫酸,硫的化合价升高,所以阳极是HSO3-溶液失去电子被氧化生成SO42-,则阳极电极反应式是:HSO3-+H2O-2e-=SO42-+3H+;
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
点评:本题考查了原电池原理和电解原理的应用,注意电极反应的书写方法,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
下列四组溶液中每组都有三种,其中可用稀H2SO4进行鉴别的一组是( )
| A、BaCl2溶液、Ba(NO3)2溶液、NaCl溶液 |
| B、Na2CO3溶液、BaCl2溶液、MgCl2溶液 |
| C、Ba(NO3)2溶液、KCl溶液、MgCl2溶液 |
| D、Na2CO3溶液、K2CO3溶液、NaCl溶液 |
电解饱和食盐水时,氢气和氢氧化钠均产生于( )
| A、正极区 | B、负极区 |
| C、阴极区 | D、阳极区 |
用石墨做电极电解下列溶液,电解完成后,向剩余的溶液中加入适量蒸馏水,能使溶液和电解前相同的是( )
| A、NaCl |
| B、Na2SO4 |
| C、HCl溶液 |
| D、AgNO3 |
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCuCO3后恰好恢复到电解前的浓度和pH.则电解过程中转移的电子数为( )
| A、0.1mol |
| B、0.2mol |
| C、0.3mol |
| D、0.4mol |
反应:2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g)已达平衡.若增大压强,平衡移动,但混合气体的平均相对分子质量不变.下列说法正确的是( )
| A、原混合气体的平均相对分子质量为30 |
| B、原混合气体的平均相对分子质量为28 |
| C、起始时,NH3与CO2的体积比为13:14 |
| D、起始时,NH3与CO2的体积比为14:15 |
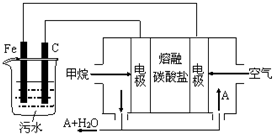 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示. 请回答下列实验室中制取气体的有关问题.
请回答下列实验室中制取气体的有关问题.